152d-bntcom01738-gi-comirnaty-30-ug-12-jahre-konzentrat-9dez2021-002
Dieses Dokument ist Teil der Anfrage „Briefverkehr mit BioNtech“
Gebrauchsinformation: Information für Anwender
Comirnaty 30 Mikrogramm/Dosis Konzentrat zur Herstellung einer Injektionsdispersion
Erwachsene und Jugendliche ab 12 Jahren
COVID-19-mRNA-Impfstoff (Nukleosid-modifiziert)
Tozinameran
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle
Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede
auftretende Nebenwirkung melden. Hinweise zur Meldung von Nebenwirkungen, siehe Ende
Abschnitt 4.
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie diesen Impfstoff erhalten,
denn sie enthält wichtige Informationen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, Apotheker oder das
medizinische Fachpersonal.
• Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das
medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser
Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Comirnaty und wofür wird es angewendet?
2. Was sollten Sie beachten, bevor Sie Comirnaty erhalten?
3. Wie wird Comirnaty angewendet?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Comirnaty aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Comirnaty und wofür wird es angewendet?
Comirnaty ist ein Impfstoff zur Vorbeugung von COVID-19 (Coronavirus-Erkrankung-2019), das
durch das SARS-CoV-2-Virus verursacht wird.
Comirnaty 30 Mikrogramm/Dosis Konzentrat zur Herstellung einer Injektionsdispersion ist für
Erwachsene und Jugendliche ab 12 Jahren.
Der Impfstoff veranlasst das Abwehrsystem (die natürlichen Abwehrkräfte des Körpers), Antikörper
und Blutzellen zu produzieren, die gegen das Virus wirken und so Schutz vor COVID-19 bieten.
Da Comirnaty das Virus nicht enthält, um Immunität zu erzeugen, kann es kein COVID-19 auslösen.
2. Was sollten Sie beachten, bevor Sie Comirnaty erhalten?
Comirnaty darf nicht angewendet werden
• wenn Sie allergisch gegen den Wirkstoff oder einen der in Abschnitt 6 genannten sonstigen
Bestandteile dieses Arzneimittels sind
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder dem medizinischen Fachpersonal, bevor Sie den
Impfstoff erhalten, wenn:
• Sie jemals eine schwere allergische Reaktion oder Atemprobleme nach einer anderen
Impfstoffinjektion hatten oder nachdem Sie in der Vergangenheit Comirnaty erhalten hatten
1

• Sie sich bei der Impfung nervös fühlen oder jemals nach einer Injektion in Ohnmacht gefallen
sind
• Sie eine schwere Krankheit oder Infektion mit hohem Fieber haben. Sie können jedoch geimpft
werden, wenn Sie leichtes Fieber oder eine Infektion der oberen Atemwege wie eine Erkältung
haben.
• Sie ein Blutungsproblem haben, leicht Blutergüsse bekommen oder ein Arzneimittel zur
Verhinderung von Blutgerinnseln verwenden
• Sie ein geschwächtes Abwehrsystem haben, aufgrund einer Erkrankung wie der HIV-Infektion
oder ein Arzneimittel verwenden, wie ein Kortikosteroid, das Ihr Abwehrsystem beeinträchtigt
Es besteht ein erhöhtes Risiko von Myokarditis (Entzündung des Herzmuskels) und Perikarditis
(Entzündung des Herzbeutels) nach der Impfung mit Comirnaty (siehe Abschnitt 4). Diese
Erkrankungen können sich innerhalb weniger Tage nach der Impfung entwickeln und traten
hauptsächlich innerhalb von 14 Tagen auf. Sie wurden häufiger nach der zweiten Impfung beobachtet
und häufiger bei jüngeren Männern. Nach der Impfung sollten Sie auf Anzeichen einer Myokarditis
oder Perikarditis wie Atemnot, Herzklopfen und Thoraxschmerzen achten und sofort einen Arzt
aufsuchen, wenn diese auftreten.
Wie bei jedem Impfstoff schützt Comirnaty möglicherweise nicht alle geimpften Personen und es ist
nicht bekannt, wie lange Sie geschützt sind.
Sie können eine dritte Dosis von Comirnaty erhalten. Die Wirksamkeit von Comirnaty kann bei
Personen mit geschwächtem Immunsystem auch nach einer dritten Dosis geringer sein. In diesen
Fällen sollten Sie weiterhin körperliche Vorsichtsmaßnahmen treffen, um COVID-19 zu verhindern.
Außerdem sollten Ihre engen Kontaktpersonen entsprechend geimpft werden. Besprechen Sie die
entsprechenden individuellen Empfehlungen mit Ihrem Arzt.
Kinder
Comirnaty wird für Kinder unter 12 Jahren nicht empfohlen.
Anwendung von Comirnaty zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden, kürzlich andere
Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden, oder kürzlich
eine andere Impfung erhalten haben.
Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen,
schwanger zu werden, fragen Sie vor dem Erhalt dieses Impfstoffes Ihren Arzt oder Apotheker um
Rat.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Einige der im Abschnitt 4 (Mögliche Nebenwirkungen) genannten Wirkungen der Impfung können
vorübergehend Ihre Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen
beeinträchtigen. Warten Sie, bis diese Wirkungen abgeklungen sind, bevor Sie Auto fahren oder
Maschinen bedienen.
Comirnaty enthält Kalium und Natrium
Dieser Impfstoff enthält Kalium, jedoch weniger als 1 mmol (39 mg) Kalium pro Dosis, d. h. es ist
nahezu „kaliumfrei“.
Dieser Impfstoff enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d. h. es ist nahezu
„natriumfrei“.
2

3. Wie wird Comirnaty angewendet?
Nach Verdünnung wird Comirnaty als Injektion von 0,3 ml in einen Muskel Ihres Oberarms
verabreicht.
Sie erhalten 2 Injektionen.
Es wird empfohlen, die zweite Dosis desselben Impfstoffs 3 Wochen nach der ersten Dosis zu
erhalten, um die Impfserie zu vervollständigen.
Eine Auffrischungsdosis (dritte Dosis) von Comirnaty kann mindestens 6 Monate nach der zweiten
Dosis bei Personen ab 18 Jahren verabreicht werden.
Wenn Sie immungeschwächt sind, können Sie eine dritte Dosis von Comirnaty mindestens 28 Tage
nach der zweiten Dosis erhalten.
Wenn Sie weitere Fragen zur Anwendung von Comirnaty haben, wenden Sie sich an Ihren Arzt,
Apotheker oder das medizinische Fachpersonal.
4. Welche Nebenwirkungen sind möglich?
Wie alle Impfstoffe kann auch Comirnaty Nebenwirkungen haben, die aber nicht bei jedem auftreten
müssen.
Sehr häufige Nebenwirkungen: kann mehr als 1 von 10 Behandelten betreffen
• an der Injektionsstelle: Schmerzen, Schwellung
• Ermüdung
• Kopfschmerzen
• Muskelschmerzen
• Schüttelfrost
• Gelenkschmerzen
• Durchfall
• Fieber
Einige dieser Nebenwirkungen traten bei Jugendlichen zwischen 12 und 15 Jahren etwas häufiger auf
als bei Erwachsenen.
Häufige Nebenwirkungen: kann bis zu 1 von 10 Behandelten betreffen
• Rötung an der Injektionsstelle
• Übelkeit
• Erbrechen
Gelegentliche Nebenwirkungen: kann bis zu 1 von 100 Behandelten betreffen
• vergrößerte Lymphknoten (häufiger beobachtet nach der Auffrischungsdosis)
• Unwohlsein
• Armschmerzen
• Schlaflosigkeit
• Jucken an der Injektionsstelle
• allergische Reaktionen wie Ausschlag oder Juckreiz
• Schwächegefühl oder Energiemangel/Schläfrigkeit
• verminderter Appetit
• starkes Schwitzen
• nächtliche Schweißausbrüche
3

Seltene Nebenwirkungen: kann bis zu 1 von 1.000 Behandelten betreffen
• vorübergehendes, einseitiges Herabhängen des Gesichtes
• allergische Reaktionen wie Nesselsucht oder Schwellung des Gesichts
Sehr seltene Nebenwirkungen: kann bis zu 1 von 10.000 Behandelten betreffen
• Entzündung des Herzmuskels (Myokarditis) oder Entzündung des Herzbeutels (Perikarditis), die
zu Atemnot, Herzklopfen oder Thoraxschmerzen führen können
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
• schwere allergische Reaktionen
• ausgedehnte Schwellung der geimpften Gliedmaße
• Anschwellen des Gesichts (ein geschwollenes Gesicht kann bei Patienten auftreten, denen in der
Vergangenheit dermatologische Filler im Gesichtsbereich injiziert wurden)
• eine Hautreaktion, die rote Flecken oder Stellen auf der Haut verursacht, die wie ein Ziel oder
eine Zielscheibenmitte mit einer dunkelroten Mitte aussehen können, das von hellroten Ringen
umgeben ist (Erythema multiforme)
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das
medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage
angegeben sind. Sie können Nebenwirkungen auch direkt dem
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51 – 59
63225 Langen
Tel.: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
anzeigen, bitte geben Sie soweit verfügbar die Chargennummer an. Indem Sie Nebenwirkungen
melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels
zur Verfügung gestellt werden.
5. Wie ist Comirnaty aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Die folgenden Informationen zur Aufbewahrung, zum Verfall, zur Verwendung und Handhabung sind
für medizinisches Fachpersonal bestimmt.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton nach „EXP“ oder
„verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich
auf den letzten Tag des angegebenen Monats.
Im Gefrierschrank bei -90 °C bis -60 °C lagern. Innerhalb der 9 Monate Haltbarkeitsdauer können
ungeöffnete Durchstechflaschen bei -25 °C bis -15 °C für insgesamt 2 Wochen gelagert und
transportiert werden und sie können danach wieder bei -90 ºC bis -60 ºC aufbewahrt werden.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Bei gefrorener Lagerung bei -90 °C bis -60 °C können Packungen mit 195 Durchstechflaschen des
Impfstoffs 3 Stunden lang bei 2 °C bis 8 °C aufgetaut werden oder einzelne Durchstechflaschen
können 30 Minuten lang bei Raumtemperatur (bis zu 30 °C) aufgetaut werden.
4

Transfers von gefrorenen Durchstechflaschen, die bei Ultratiefkühlung (< -60 °C) gelagert wurden
• Durchstechflaschen-Trays mit geschlossenem Deckel und 195 Durchstechflaschen, die gefroren
aus der Ultratiefkühlung (< -60 °C) entnommen wurden, können bis zu 5 Minuten bei
Temperaturen bis zu 25 °C bleiben.
• Durchstechflaschen-Trays mit geöffnetem Deckel, oder Durchstechflaschen-Trays mit weniger
als 195 Durchstechflaschen, die gefroren aus der Tiefkühllagerung (< -60 °C) entnommen
wurden, können bis zu 3 Minuten bei Temperaturen bis zu 25 °C bleiben.
• Nachdem die Durchstechflaschen-Trays nach der Exposition bei Temperaturen von bis zu 25 °C
wieder in die Tiefkühllagerung gebracht wurden, müssen sie mindestens 2 Stunden in der
Tiefkühllagerung verbleiben, bevor sie wieder entnommen werden können.
Transfers von gefrorenen Durchstechflaschen, die bei -25 °C bis -15 °C gelagert wurden
• Durchstechflaschen-Trays mit geschlossenem Deckel und 195 Durchstechflaschen, die aus
gefrorener Lagerung (-25 °C bis -15 °C) entnommen wurden, können bis zu 3 Minuten bei
Temperaturen bis zu 25 °C bleiben.
• Durchstechflaschen-Trays mit geöffnetem Deckel, oder Durchstechflaschen-Trays mit weniger
als 195 Durchstechflaschen, die aus gefrorener Lagerung (-25 °C bis -15 °C) entnommen
wurden, können bis zu 1 Minute bei Temperaturen bis zu 25 °C bleiben.
Sobald eine Durchstechflasche aus dem Durchstechflaschen-Trays entnommen wurde, sollte sie zur
Verwendung aufgetaut werden.
Nach dem Auftauen sollte der Impfstoff verdünnt und unverzüglich verwendet werden.
Stabilitätsdaten während des Gebrauchs nach dem Auftauen haben jedoch gezeigt, dass der
unverdünnte Impfstoff nach der Entnahme aus dem Gefrierschrank bis zu 1 Monat bei 2 °C bis 8 °C
innerhalb der 9-monatigen Haltbarkeit gelagert werden kann. Innerhalb der 1-monatigen
Haltbarkeitsdauer bei 2 °C bis 8 °C können bis zu 12 Stunden für den Transport genutzt werden. Vor
der Verwendung kann der ungeöffnete Impfstoff bis zu 2 Stunden bei Temperaturen bis 30 °C gelagert
werden kann.
Aufgetaute Durchstechflaschen können bei Raumlicht gehandhabt werden.
Lagern und transportieren Sie den Impfstoff nach dem Verdünnen bei 2 °C bis 30 °C und verwenden
Sie ihn innerhalb von 6 Stunden. Entsorgen Sie nicht verwendeten Impfstoff.
Nach dem Herausnehmen aus dem Gefrierschrank und Verdünnen sollten die Durchstechflaschen mit
dem neuen Datum und Uhrzeit der Entsorgung gekennzeichnet werden. Nach dem Auftauen darf der
Impfstoff nicht mehr eingefroren werden.
Verwenden Sie diesen Impfstoff nicht, wenn Sie Partikel in der Verdünnung oder eine Verfärbung
bemerken.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie
das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der
Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was Comirnaty enthält
• Der Wirkstoff ist ein COVID-19-mRNA-Impfstoff mit der Bezeichnung Tozinameran. Nach der
Verdünnung enthält die Durchstechflasche 6 Dosen von 0,3 ml mit jeweils 30 Mikrogramm
Tozinameran.
• Die sonstigen Bestandteile sind:
− ((4-Hydroxybutyl)azandiyl)bis(hexan-6,1-diyl)bis(2-hexyldecanoat) (ALC-0315)
− 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid (ALC-0159)
5

− Colfoscerilstearat (DSPC)
− Cholesterol
− Kaliumchlorid
− Kaliumdihydrogenphosphat
− Natriumchlorid
− Natriummonohydrogenphosphat Dihydrat
− Sucrose
− Wasser für Injektionszwecke
− Natriumhydroxid (zur pH-Einstellung)
− Salzsäure (zur pH-Einstellung)
Wie Comirnaty aussieht und Inhalt der Packung
Der Impfstoff ist eine weiße bis grauweiße Dispersion (pH: 6,9 - 7,9), die in einer
Mehrdosendurchstechflasche mit 6 Dosen in einer klaren 2 ml-Durchstechflasche (Typ I-Glas) mit
einem Gummistopfen und einer violetten Flip-off-Kunststoffkappe mit einem Verschluss aus
Aluminium bereitgestellt wird.
Packungsgröße: 195 Durchstechflaschen
Pharmazeutischer Unternehmer
BioNTech Manufacturing GmbH
An der Goldgrube 12
55131 Mainz
Deutschland
Telefon: +49 6131 9084-0
Fax: +49 6131 9084-2121
service@biontech.de
Hersteller
BioNTech Manufacturing GmbH
Kupferbergterrasse 17 - 19
55116 Mainz
Deutschland
Pfizer Manufacturing Belgium NV
Rijksweg 12
2870 Puurs
Belgien
Falls Sie weitere Informationen über das Arzneimittel wünschen, setzen Sie sich bitte mit dem
örtlichen Vertreter des pharmazeutischen Unternehmers in Verbindung.
België/Belgique/Belgien Lietuva
Luxembourg/Luxemburg Pfizer Luxembourg SARL filialas Lietuvoje
Pfizer S.A./N.V. Tel. + 370 52 51 4000
Tél/Tel: + 32 (0)2 554 62 11
България Magyarország
Пфайзер Люксембург САРЛ, Клон Pfizer Kft
България Tel: +36 1 488 3700
Teл: +359 2 970 4333
Česká republika Malta
Pfizer, spol. s r.o. Vivian Corporation Ltd.
Tel: +420 283 004 111 Tel: + 35621 344610
6

Danmark Norge
Pfizer ApS Pfizer AS
Tlf: + 45 44 201 100 Tlf: +47 67 526 100
Deutschland Nederland
BioNTech Manufacturing GmbH Pfizer BV
Tel: +49 6131 90840 Tel: +31 (0)10 406 43 01
Eesti Österreich
Pfizer Luxembourg SARL Eesti filiaal Pfizer Corporation Austria Ges.m.b.H.
Tel: +372 666 7500 Tel: + 43 (0)1 521 15-0
Ελλάδα Polska
Pfizer Ελλάς A.E. Pfizer Polska Sp. z o.o.
Τηλ.: +30 210 6785 800 Tel.: +48 22 335 61 00
España Portugal
Pfizer, S.L. Laboratórios Pfizer, Lda.
Tel:+34914909900 Tel: +351 21 423 5500
France România
Pfizer Pfizer Romania S.R.L
Tél +33 1 58 07 34 40 Tel: +40 (0) 21 207 28 00
Hrvatska Slovenija
Pfizer Croatia d.o.o. Pfizer Luxembourg SARL
Tel: + 385 1 3908 777 Pfizer, podružnica za svetovanje s področja
farmacevtske dejavnosti, Ljubljana
Tel.: + 386 (0) 1 52 11 400
Ireland Slovenská republika
Pfizer Healthcare Ireland Pfizer Luxembourg SARL,
Tel: 1800 633 363 (toll free) organizačná zložka
+44 (0)1304 616161 Tel: + 421 2 3355 5500
Ísland Suomi/Finland
Icepharma hf Pfizer Oy
Simi: + 354 540 8000 Puh/Tel: +358 (0)9 430 040
Italia Sverige
Pfizer S.r.l. Pfizer AB
Tel: +39 06 33 18 21 Tel: +46 (0)8 550 520 00
Κύπρος United Kingdom (Northern Ireland)
Pfizer Ελλάς Α.Ε. (Cyprus Branch) Pfizer Limited
Tηλ: +357 22 817690 Tel: +44 (0) 1304 616161
Latvija
Pfizer Luxembourg SARL filiāle Latvijā
Tel.: + 371 670 35 775
Diese Packungsbeilage wurde zuletzt überarbeitet am 9. Dezember 2021.
Dieses Arzneimittel wurde unter „Besonderen Bedingungen“ zugelassen. Das bedeutet, dass weitere
Nachweise für den Nutzen des Arzneimittels erwartet werden.
Die Europäische Arzneimittel-Agentur wird neue Informationen zu diesem Arzneimittel mindestens
jährlich bewerten und, falls erforderlich, wird die Packungsbeilage aktualisiert werden.
7

Scannen Sie den Code mit einem mobilen Gerät, um die Packungsbeilage in verschiedenen Sprachen
zu erhalten.
URL: www.comirnatyglobal.com
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen
Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.
Diese Packungsbeilage ist auf den Internetseiten der Europäischen Arzneimittel-Agentur in allen
EU/EEA-Amtssprachen verfügbar.
------------------------------------------------------------------------------------------------------------------------
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Verabreichen Sie Comirnaty intramuskulär nach Verdünnung als eine primäre Serie von 2 Dosen (je
0,3 ml) im Abstand von 3 Wochen.
Eine Auffrischungsdosis (dritte Dosis) von Comirnaty kann mindestens 6 Monate nach der zweiten
Dosis bei Personen ab 18 Jahren verabreicht werden.
Eine dritte Dosis kann mindestens 28 Tage nach der zweiten Dosis an Personen mit starker
Immunschwäche verabreicht werden
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des
Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert
werden.
Handhabungsanweisungen
Comirnaty sollte vom medizinischen Fachpersonal unter Verwendung aseptischer Techniken
zubereitet werden, um die Sterilität der zubereiteten Dispersion sicherzustellen.
8

ÜBERPRÜFUNG DER DOSIS VON COMIRNATY 30 MIKROGRAMM/DOSIS KONZENTRAT ZUR
HERSTELLUNG EINER INJEKTIONSDISPERSION (AB 12 JAHREN)
• Vergewissern Sie sich, dass die
Durchstechflasche eine violette
Kunststoffkappe hat.
Violette Kappe • Wenn die Durchstechflasche eine graue
Kunststoffkappe hat, beachten Sie bitte
die Zusammenfassung der Merkmale
des Arzneimittels Comirnaty
30 Mikrogramm/Dosis
Injektionsdispersion.
• Wenn die Durchstechflasche eine
orange Kunststoffkappe hat, beachten
Sie bitte die Zusammenfassung der
Merkmale des Arzneimittels Comirnaty
10 Mikrogramm/Dosis Konzentrat zur
Herstellung einer Injektionsdispersion.
AUFTAUEN VOR DEM VERDÜNNEN VON COMIRNATY 30 MIKROGRAMM/DOSIS
KONZENTRAT ZUR HERSTELLUNG EINER INJEKTIONSDISPERSION (AB 12 JAHREN)
• Die Mehrdosendurchstechflasche wird
gefroren gelagert und muss vor der
Verdünnung aufgetaut werden. Die
gefrorenen Durchstechflaschen sollten
Nicht mehr als zum Auftauen in eine Umgebung von
2 Stunden bei 2 °C bis 8 °C gebracht werden. Das
Raumtemperatur Auftauen einer 195-
(bis zu 30 °C) Durchstechflaschen-Packung kann
3 Stunden dauern. Alternativ können
gefrorene Durchstechflaschen zur
sofortigen Verwendung auch
30 Minuten lang bei Temperaturen bis
zu 30 °C aufgetaut werden.
• Die ungeöffnete Durchstechflasche
kann bis zu 1 Monat bei 2 °C bis 8 °C
innerhalb der 9-monatigen
Haltbarkeitsdauer gelagert werden.
Innerhalb der 1-monatigen
Haltbarkeitsdauer bei 2 °C bis 8 °C
können bis zu 12 Stunden für den
Transport genutzt werden.
• Lassen Sie die aufgetaute
Durchstechflasche Raumtemperatur
annehmen. Vor Gebrauch kann die
ungeöffnete Durchstechflasche bis zu
2 Stunden bei Temperaturen bis 30 °C
gelagert werden. Aufgetaute
Durchstechflaschen können bei
Raumlicht gehandhabt werden.
• Drehen Sie die Durchstechflasche vor
der Verdünnung 10-mal vorsichtig um.
Nicht schütteln.
• Vor dem Verdünnen kann die
aufgetaute Dispersion weiße bis
grauweiße, undurchsichtige, amorphe
Partikel enthalten.
9

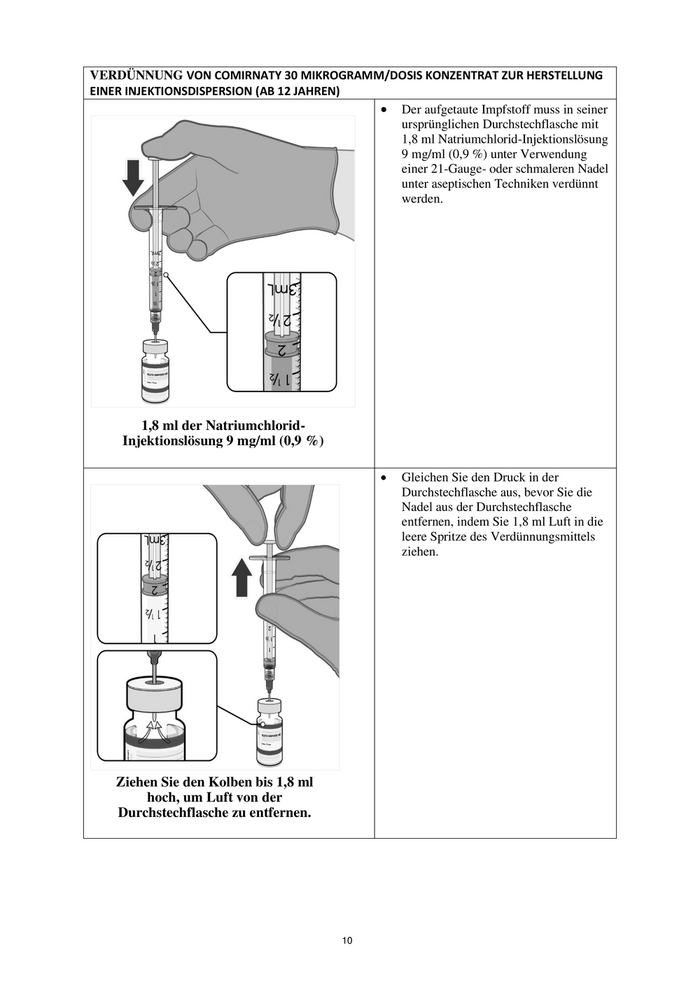
VERDÜNNUNG VON COMIRNATY 30 MIKROGRAMM/DOSIS KONZENTRAT ZUR HERSTELLUNG
EINER INJEKTIONSDISPERSION (AB 12 JAHREN)
• Der aufgetaute Impfstoff muss in seiner
ursprünglichen Durchstechflasche mit
1,8 ml Natriumchlorid-Injektionslösung
9 mg/ml (0,9 %) unter Verwendung
einer 21-Gauge- oder schmaleren Nadel
unter aseptischen Techniken verdünnt
werden.
1,8 ml der Natriumchlorid-
Injektionslösung 9 mg/ml (0,9 %)
• Gleichen Sie den Druck in der
Durchstechflasche aus, bevor Sie die
Nadel aus der Durchstechflasche
entfernen, indem Sie 1,8 ml Luft in die
leere Spritze des Verdünnungsmittels
ziehen.
Ziehen Sie den Kolben bis 1,8 ml
hoch, um Luft von der
Durchstechflasche zu entfernen.
10