194c-comirnaty-adhaesionsfolie-rtu-220105-002
Dieses Dokument ist Teil der Anfrage „Briefverkehr mit BioNtech“
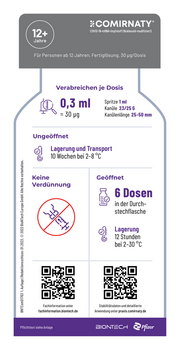
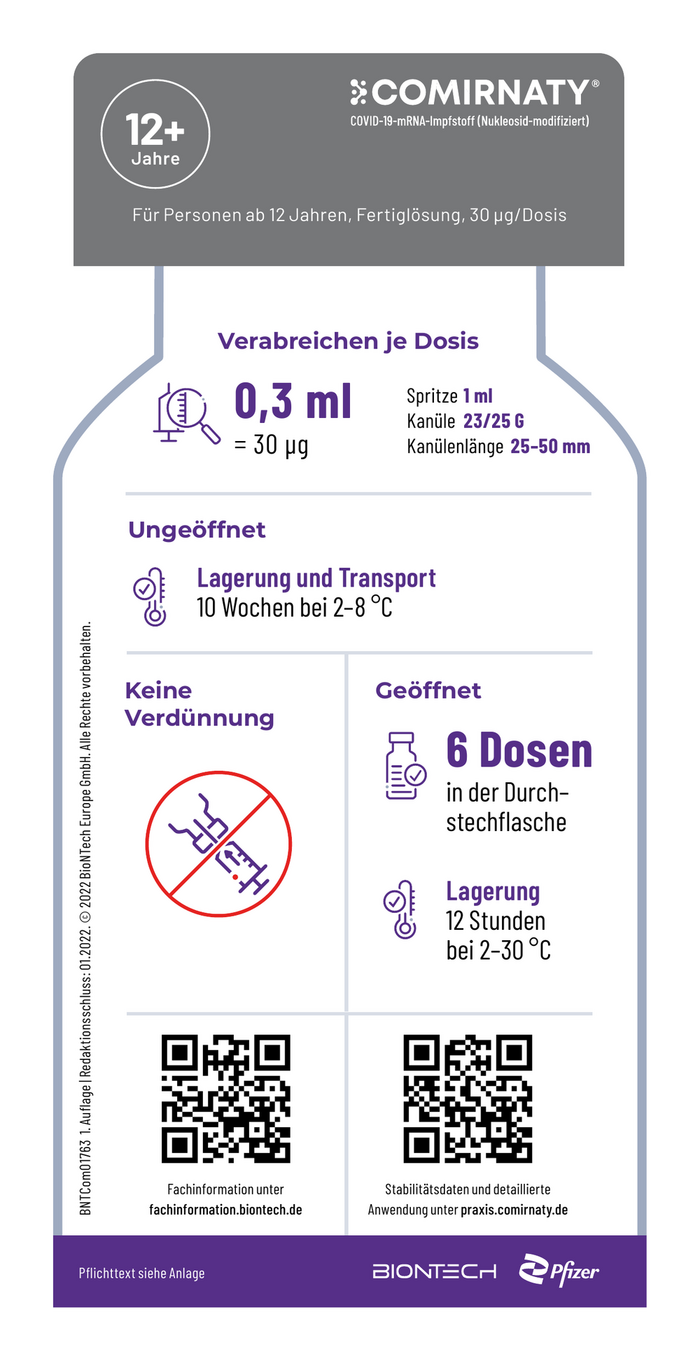
12+
Jahre
Für Personen ab 12 Jahren, Fertiglösung, 30 μg/Dosis
Verabreichen je Dosis
0,3 ml Spritze 1 ml
Kanüle 23/25 G
= 30 µg Kanülenlänge 25–50 mm
Ungeöffnet
Lagerung und Transport
10 Wochen bei 2–8 °C
BNTCom01763 1. Auflage | Redaktionsschluss: 01.2022. © 2022 BioNTech Europe GmbH. Alle Rechte vorbehalten.
Keine Geöffnet
Verdünnung
6 Dosen
in der Durch–
stechflasche
Lagerung
12 Stunden
bei 2–30 °C
Fachinformation unter Stabilitätsdaten und detaillierte
fachinformation.biontech.de Anwendung unter praxis.comirnaty.de
Pflichttext siehe Anlage
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung COMIRNATY® Wirkstoff: Tozinameran, COVID-19-mRNA-Impfstoff. COMIRNATY® 30 Mikrogramm/Dosis Konzentrat zur Herstellung einer Injektionsdispersion (ab 12 Jahre): Zusammensetzung: Nach der Verdünnung enthält die Durchstechflasche 6 Dosen von 0,3 ml mit jeweils 30 Mikrogramm mRNA. Sonstige Bestandteile: ((4-Hydroxybutyl)azandiyl)bis(hexan-6,1-diyl) bis(2-hexyldecanoat) (ALC-0315), 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid (ALC-0159), Colfoscerilstearat (DSPC), Cholesterol, Kaliumchlorid, Kaliumdihydrogenphosphat, Natriumchlorid, Natriummonohydrogenphosphat Dihydrat, Sucrose, Wasser für Injektionszwecke, Natriumhydroxid (zur pH-Einstellung), Salzsäure (zur pH-Einstellung) COMIRNATY® 30 Mikrogramm/Dosis Injektionsdispersion (ab 12 Jahre): Zusammensetzung: Eine Durchstechflasche enthält 6 Dosen von 0,3 ml mit jeweils 30 Mikrogramm mRNA. Sonstige Bestandteile: ((4-Hydroxybutyl)azandiyl)bis(hexan-6,1-diyl)bis(2-hexyldecanoat) (ALC- 0315), 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid (ALC-0159), Colfoscerilstearat (DSPC), Cholesterol, Trometamol, Trometamolhydrochlorid, Sucrose, Wasser für Injektionszwecke. COMIRNATY® 10 Mikrogramm/Dosis Konzentrat zur Herstellung einer Injektionsdispersion (5-11 Jahre): Zusammensetzung: Nach der Verdünnung enthält die Durchstechflasche 10 Dosen von 0,2 ml mit jeweils 10 Mikrogramm mRNA. Sonstige Bestandteile: ((4-Hydroxybutyl)azandiyl)bis(hexan-6,1-diyl) bis(2-hexyldecanoat) (ALC-0315), 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid (ALC-0159), Colfoscerilstearat (DSPC), Cholesterol, Trometamol, Trometamolhydrochlorid, Sucrose, Wasser für Injektionszwecke. Anwendungsgebiete: Aktive Immunisierung zur Vorbeugung von COVID-19 durch das SARS-CoV-2-Virus bei Kindern im Alter von 5 bis 11 Jahren (Dosis 10 Mikrogramm in 0,2ml) bzw. Personen ab 12 Jahren (Dosis 30 Mikrogramm in 0,3ml). Gegenanzeigen: Allergie gegen einen der Bestandteile des Arzneimittels. Nebenwirkungen: Sehr häufig: Schmerzen, Schwellung, Rötung (bei 5-11-jährigen Kindern) an der Injektionsstelle; Ermüdung; Kopfschmerzen; Muskelschmerzen; Schüttelfrost, Gelenkschmerzen; Durchfall, Fieber. Häufig: Rötung an der Injektionsstelle; Übelkeit, Erbrechen. Gelegentlich: vergrößerte Lymphknoten (häufiger beobachtet nach der Auffrischungsdosis); Unwohlsein; Armschmerzen; Schlaflosigkeit; Jucken an der Injektionsstelle, allergische Reaktionen wie Ausschlag oder Juckreiz; Schwächegefühl oder Energiemangel/Schläfrigkeit, verminderter Appetit, starkes Schwitzen, nächtliche Schweißausbrüche. Selten: vorübergehendes, einseitiges Herabhängen des Gesichtes; allergische Reaktionen wie Nesselsucht oder Schwellung des Gesichts. Sehr seltene Nebenwirkungen: Entzündung des Herzmuskels (Myokarditis) oder Entzündung des Herzbeutels (Perikarditis), die zu Atemnot, Herzklopfen oder Thoraxschmerzen führen können. Häufigkeit nicht bekannt: schwere allergische Reaktionen; ausgedehnte Schwellung der geimpften Gliedmaße; Anschwellen des Gesichts (ein geschwollenes Gesicht kann bei Patienten auftreten, denen in der Vergangenheit dermatologische Filler im Gesichtsbereich injiziert wurden); eine Hautreaktion, die rote Flecken oder Stellen auf der Haut verursacht, die wie ein Ziel oder eine Zielscheibenmitte mit einer dunkelroten Mitte aussehen können, das von hellroten Ringen umgeben ist (Erythema multiforme). Verschreibungspflichtig. Stand der Informationen: 9. Dezember 2021. Pharmazeutischer Unternehmer: BioNTech Manufacturing GmbH, An der Goldgrube 12, 55131 Mainz. Weitere Informationen, Warnhinweise und Vorsichtsmaßnahmen sind der Fachinformation zu entnehmen. www.comirnatyglobal.com.