221a-ema-combined-h-5735-de-003
Dieses Dokument ist Teil der Anfrage „Briefverkehr mit BioNtech“
ANHANG I
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1

Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle
Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind
aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von
Nebenwirkungen, siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
Comirnaty Konzentrat zur Herstellung einer Injektionsdispersion
COVID-19-mRNA-Impfstoff (Nukleosid-modifiziert)
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Dies ist eine Mehrdosendurchstechflasche, deren Inhalt vor der Verwendung verdünnt werden muss.
Eine Durchstechflasche (0,45 ml) enthält nach dem Verdünnen 6 Dosen von je 0,3 ml, siehe
Abschnitte 4.2 und 6.6.
1 Dosis (0,3 ml) enthält 30 Mikrogramm COVID-19-mRNA-Impfstoff (eingebettet in Lipid-
Nanopartikel).
Einzelsträngige, 5'-gekappte Boten-RNA (mRNA), die unter Verwendung einer zellfreien in-vitro-
Transkription aus den entsprechenden DNA-Vorlagen hergestellt wird und das virale Spike (S)-
Protein von SARS-CoV-2 kodiert.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Konzentrat zur Herstellung einer Injektionsdispersion (steriles Konzentrat)
Der Impfstoff ist eine weiße bis grauweiße, gefrorene Dispersion (pH: 6,9 - 7,9).
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Comirnaty wird zur aktiven Immunisierung von Personen ab 12 Jahren zur Vorbeugung von
COVID-19 durch das SARS-CoV-2-Virus angewendet.
Die Anwendung des Impfstoffs sollte in Übereinstimmung mit den offiziellen Empfehlungen erfolgen.
4.2 Dosierung und Art der Anwendung
Dosierung
Personen ab 12 Jahren
Comirnaty wird nach Verdünnung intramuskulär in einer primären Impfserie von 2 Dosen (je 0,3 ml)
verabreicht. Es wird empfohlen, die zweite Dosis 3 Wochen nach der ersten Dosis zu verabreichen
(siehe Abschnitte 4.4 und 5.1).
Eine Auffrischungsdosis (dritte Dosis) von Comirnaty kann mindestens 6 Monate nach der zweiten
Dosis bei Personen ab 18 Jahren intramuskulär verabreicht werden. Die Entscheidung, wann und bei
wem eine dritte Dosis Comirnaty verabreicht werden soll, sollte auf der Grundlage der verfügbaren
2

Daten zur Wirksamkeit des Impfstoffs unter Berücksichtigung der begrenzten Sicherheitsdaten
getroffen werden (siehe Abschnitte 4.4 und 5.1).
Die Austauschbarkeit von Comirnaty mit anderen COVID-19-Impfstoffen zur Vervollständigung der
primären Impfserie oder der Auffrischungsdosis (dritte Dosis) ist nicht erwiesen. Personen, die
1 Dosis Comirnaty erhalten haben, sollten Comirnaty für die zweite Dosis zum Abschluss der
primären Impfserie erhalten sowie für alle weiteren Dosen.
Stark immunsupprimierte Personen ab 12 Jahren
Eine dritte Dosis kann mindestens 28 Tage nach der zweiten Dosis an Personen mit starker
Immunsupprimierung verabreicht werden (siehe Abschnitt 4.4).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Comirnaty bei Kindern unter 12 Jahren ist bisher noch nicht
erwiesen. Begrenzte Daten sind verfügbar.
Ältere Personen
Bei älteren Personen ab 65 Jahren ist keine Dosisanpassung erforderlich. Die Sicherheit und
Immunogenität einer Auffrischungsdosis (dritte Dosis) von Comirnaty bei Personen ab 65 Jahren
basiert auf Daten zur Sicherheit und Immunogenität bei Erwachsenen im Alter von 18 bis 55 Jahren.
Art der Anwendung
Comirnaty sollte nach dem Verdünnen intramuskulär verabreicht werden (siehe Abschnitt 6.6).
Nach dem Verdünnen enthalten die Durchstechflaschen von Comirnaty sechs Dosen von je 0,3 ml des
Impfstoffs. Um sechs Dosen aus einer einzelnen Durchstechflasche zu entnehmen, sollten Spritzen
und/oder Nadeln mit geringem Totvolumen verwendet werden. Die Kombination aus Spritze und
Nadel mit geringem Totvolumen sollte ein Totvolumen von nicht mehr als 35 Mikrolitern haben.
Wenn Standardspritzen und -nadeln verwendet werden, reicht das Volumen möglicherweise nicht aus,
um eine sechste Dosis aus einer einzelnen Durchstechflasche zu entnehmen.
Unabhängig vom Typ der Spritze und Nadel:
• Jede Dosis muss 0,3 ml des Impfstoffs enthalten.
• Wenn die in der Durchstechflasche verbleibende Impfstoffmenge nicht für eine volle Dosis von
0,3 ml ausreicht, entsorgen Sie die Durchstechflasche mit dem überschüssigen Volumen.
• Überschüssiger Impfstoff von mehreren Durchstechflaschen darf nicht zusammengeführt
werden.
Die bevorzugte Stelle ist der Deltamuskel des Oberarms.
Injizieren Sie den Impfstoff nicht intravaskulär, subkutan oder intradermal.
Der Impfstoff sollte nicht mit anderen Impfstoffen oder Arzneimitteln in derselben Spritze gemischt
werden.
Für Vorsichtsmaßnahmen vor der Verabreichung des Impfstoffs siehe Abschnitt 4.4.
Hinweise zum Auftauen, zur Handhabung und Beseitigung des Impfstoffs siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen
Bestandteile.
3

4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des
Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert
werden.
Allgemeine Empfehlungen
Überempfindlichkeit und Anaphylaxie
Es wurden Fälle von Anaphylaxie berichtet. Für den Fall einer anaphylaktischen Reaktion nach der
Verabreichung des Impfstoffs sollte immer eine angemessene medizinische Versorgung und
Überwachung bereitstehen.
Nach der Impfung wird eine engmaschige Beobachtung von mindestens 15 Minuten empfohlen. Eine
zweite Dosis des Impfstoffs sollte nicht an Personen verabreicht werden, bei denen eine Anaphylaxie
nach der ersten Dosis von Comirnaty aufgetreten ist.
Myokarditis und Perikarditis
Nach der Impfung mit Comirnaty wurden sehr seltene Fälle von Myokarditis und Perikarditis
beobachtet. Diese Fälle traten hauptsächlich innerhalb von 14 Tagen nach der Impfung auf, häufiger
nach der zweiten Impfung und häufiger bei jüngeren Männern. Die verfügbaren Daten deuten darauf
hin, dass sich der Verlauf der Myokarditis und Perikarditis nach der Impfung nicht von einer
Myokarditis oder Perikarditis im Allgemeinen unterscheidet.
Angehörige der Heilberufe sollten auf Anzeichen und Symptome einer Myokarditis oder Perikarditis
achten. Die Geimpften sollten angewiesen werden, sofort einen Arzt aufzusuchen, wenn sich bei ihnen
Symptome zeigen, die auf eine Myokarditis oder Perikarditis hinweisen, wie (akute und anhaltende)
Schmerzen in der Brust, Kurzatmigkeit oder Herzklopfen nach der Impfung.
Angehörige der Gesundheitsberufe sollten Leitlinien und/oder Spezialisten für die Diagnose und
Behandlung dieser Erkrankung konsultieren.
Das Risiko von Myokarditis nach der dritten Dosis von Comirnaty ist noch nicht bekannt.
Angstbedingte-Reaktionen
Angstbedingte Reaktionen, einschließlich vasovagale Reaktionen (Synkope), Hyperventilation oder
stressbedingte Reaktionen (z. B. Schwindelgefühl, Herzklopfen, Anstieg der Herzfrequenz,
Blutdruckveränderungen, Kribbeln und Schwitzen) können im Zusammenhang mit dem Impfvorgang
selbst auftreten. Stressbedingte Reaktionen sind vorübergehend und klingen von selbst wieder ab. Die
Betroffenen sollten darauf hingewiesen werden, die Symptome dem Impfarzt mitzuteilen, damit dieser
sie beurteilen kann. Es ist wichtig, dass Vorkehrungen getroffen werden, um Verletzungen durch
Ohnmachtsanfälle zu vermeiden.
Gleichzeitige Erkrankung
Die Impfung sollte bei Personen mit akuter, schwerer, fieberhafter Erkrankung oder akuter Infektion
verschoben werden. Das Vorliegen einer geringfügigen Infektion und/oder leichtem Fieber sollte die
Impfung nicht verzögern.
Thrombozytopenie und Gerinnungsstörungen
Wie bei anderen intramuskulären Injektionen sollte der Impfstoff bei Personen, die eine
Antikoagulationstherapie erhalten, oder bei Personen mit Thrombozytopenie oder einer
Gerinnungsstörung (wie Hämophilie) mit Vorsicht verabreicht werden, da bei diesen Personen nach
einer intramuskulären Verabreichung Blutungen oder Blutergüsse auftreten können.
4

Immunsupprimierte Personen
Die Wirksamkeit und Sicherheit des Impfstoffs wurde bei immunsupprimierten Personen,
einschließlich Personen die Immunsuppressiva erhielten, nicht bewertet. Die Wirksamkeit von
Comirnaty könnte bei immunsupprimierten Personen geringer sein.
Die Empfehlung, bei stark immunsupprimierten Personen eine dritte Dosis in Betracht zu ziehen,
basiert auf begrenzten serologischen Nachweisen aus einer Fallserie in der Literatur zur klinischen
Behandlung von Patienten mit iatrogener Immunsuppression nach Transplantation solider Organe
(siehe Abschnitt 4.2).
Dauer des Impfschutzes
Die Dauer der Schutzwirkung des Impfstoffs ist nicht bekannt, da sie noch in laufenden klinischen
Studien ermittelt wird.
Einschränkungen der Wirksamkeit des Impfstoffs
Wie bei jedem Impfstoff schützt die Impfung mit Comirnaty möglicherweise nicht jeden Geimpften.
Personen sind möglicherweise erst 7 Tage nach ihrer zweiten Impfdosis vollständig geschützt.
Sonstige Bestandteile
Dieser Impfstoff enthält Kalium, jedoch weniger als 1 mmol (39 mg) Kalium pro Dosis, d. h. es ist
nahezu „kaliumfrei“.
Dieser Impfstoff enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d. h. es ist nahezu
„natriumfrei“.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
Die gleichzeitige Verabreichung von Comirnaty mit anderen Impfstoffen wurde nicht untersucht.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen nur begrenzte Erfahrungen mit der Anwendung von Comirnaty bei Schwangeren vor.
Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Wirkungen in Bezug auf
Schwangerschaft, embryonale/fötale Entwicklung, Geburt oder postnatale Entwicklung schließen
(siehe Abschnitt 5.3). Die Verabreichung von Comirnaty in der Schwangerschaft sollte nur in Betracht
gezogen werden, wenn der potenzielle Nutzen die möglichen Risiken für Mutter und Fötus überwiegt.
Stillzeit
Es ist nicht bekannt, ob Comirnaty in die Muttermilch übergeht.
Fertilität
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche
Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von
Maschinen
Comirnaty hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die
Fähigkeit zum Bedienen von Maschinen. Einige der in Abschnitt 4.8 genannten Effekte können jedoch
5

vorübergehend die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
beeinträchtigen.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die Sicherheit von Comirnaty wurde bei Teilnehmern ab 12 Jahren in 2 klinischen Studien untersucht,
in denen 23.205 Teilnehmer (bestehend aus 22.074 Teilnehmern ab 16 Jahren und 1.131 Jugendlichen
im Alter von 12 bis 15 Jahren) mindestens eine Dosis von Comirnaty erhalten haben.
Das allgemeine Sicherheitsprofil von Comirnaty bei Jugendlichen im Alter von 12 bis 15 Jahren war
ähnlich wie bei Teilnehmern ab 16 Jahren.
Zusätzlich erhielten 306 Teilnehmer der Phase 3 im Alter von 18 bis 55 Jahren eine
Auffrischungsdosis (dritte Dosis) von Comirnaty etwa 6 Monate nach der zweiten Dosis. Das
allgemeine Sicherheitsprofil für die Auffrischungsdosis (dritte Dosis) war ähnlich wie das nach 2
Dosen.
Teilnehmer ab 16 Jahren – nach 2 Dosen
In Studie 2 erhielten insgesamt 22.026 Teilnehmer ab 16 Jahren mindestens 1 Dosis Comirnaty und
insgesamt 22.021 Teilnehmer ab 16 Jahren erhielten Placebo (darunter 138 und 145 Jugendliche im
Alter von 16 und 17 Jahren in der Impfstoff- bzw. Placebogruppe). Insgesamt 20.519 Teilnehmer ab
16 Jahren erhielten 2 Dosen Comirnaty.
Zum Zeitpunkt der Analyse von Studie 2 mit einem Datenstichtag zum 13. März 2021 für den
placebokontrollierten verblindeten Nachbeobachtungszeitraum bis zum Entblindungsdatum der
Teilnehmer wurden insgesamt 25.651 (58,2 %) Teilnehmer (13.031 Comirnaty und 12.620 Placebo)
ab 16 Jahren nach der zweiten Dosis ≥ 4 Monate nachbeobachtet. Darunter waren insgesamt 15.111
(7.704 Comirnaty und 7.407 Placebo) Teilnehmer im Alter von 16 bis 55 Jahren und insgesamt 10.540
(5.327 Comirnaty und 5.213 Placebo) Teilnehmer ab 56 Jahren.
Die häufigsten Nebenwirkungen bei Teilnehmern ab 16 Jahren, die 2 Dosen erhielten, waren
Schmerzen an der Injektionsstelle (> 80 %), Ermüdung (> 60 %), Kopfschmerzen (> 50 %), Myalgie
(> 40 %), Schüttelfrost (> 30 %), Arthralgie (> 20) %), Fieber und Schwellung an der Injektionsstelle
(> 10 %), die normalerweise von leichter oder mäßiger Intensität waren und innerhalb weniger Tage
nach der Impfung abklangen. Eine etwas geringere Häufigkeit von Reaktogenitätsereignissen war mit
einem höheren Alter verbunden.
Das Sicherheitsprofil bei 545 Teilnehmern ab 16 Jahren, die Comirnaty erhielten und zu
Studienbeginn seropositiv für SARS-CoV-2 waren, war ähnlich wie in der Allgemeinbevölkerung.
Jugendliche zwischen 12 und 15 Jahren – nach 2 Dosen
In einer Analyse von Studie 2, basierend auf Daten bis zum Stichtag 13. März 2021, waren
2.260 Jugendliche (1.131 Comirnaty und 1.129 Placebo) 12 bis 15 Jahre alt. Davon wurden
1.308 Jugendliche (660 Comirnaty und 648 Placebo) nach der zweiten Comirnaty-Dosis mindestens
2 Monate lang beobachtet. Die Sicherheitsbewertung in Studie 2 wird fortgeführt.
Die häufigsten Nebenwirkungen bei Jugendlichen im Alter von 12 bis 15 Jahren, die 2 Dosen
erhielten, waren Schmerzen an der Injektionsstelle (> 90 %), Ermüdung und Kopfschmerzen (> 70 %),
Myalgie und Schüttelfrost (> 40 %), Arthralgie und Fieber (> 20 %).
Teilnehmer ab 18 Jahren – nach Auffrischungsdosis (dritte Dosis)
Eine Untergruppe von 306 Erwachsenen im Alter von 18 bis 55 Jahren aus der Phase 2/3 der Studie 2,
die den ursprünglichen Comirnaty-Zyklus mit zwei Dosen abgeschlossen hatten, erhielt eine
Auffrischungsdosis (dritte Dosis) von Comirnaty etwa 6 Monate (Bereich von 4,8 bis 8,0 Monaten)
nach Erhalt der zweiten Dosis.
6

Die häufigsten Nebenwirkungen bei den Teilnehmern im Alter von 18 bis 55 Jahren waren Schmerzen
an der Injektionsstelle (> 80 %), Ermüdung (> 60 %), Kopfschmerzen (> 40 %), Myalgie (> 30 %),
Schüttelfrost und Arthralgie (> 20 %).
Tabellarische Auflistung der Nebenwirkungen aus klinischen Studien und Erfahrungen nach der
Zulassung bei Personen ab 12 Jahren
Nebenwirkungen, die während klinischer Studien beobachtet wurden, sind unten entsprechend
folgender Häufigkeitskategorien aufgeführt:
Sehr häufig (≥ 1/10),
Häufig (≥ 1/100, < 1/10),
Gelegentlich (≥ 1/1.000, < 1/100),
Selten (≥ 1/10.000, < 1/1.000),
Sehr selten (< 1/10.000),
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
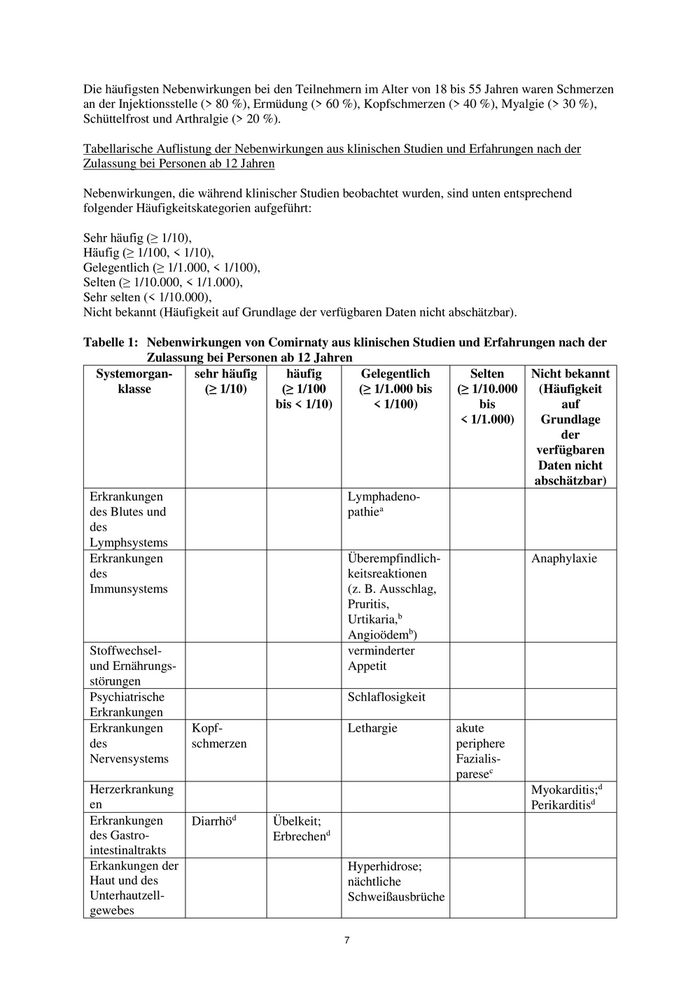
Tabelle 1: Nebenwirkungen von Comirnaty aus klinischen Studien und Erfahrungen nach der
Zulassung bei Personen ab 12 Jahren
Systemorgan- sehr häufig häufig Gelegentlich Selten Nicht bekannt
klasse (≥ 1/10) (≥ 1/100 (≥ 1/1.000 bis (≥ 1/10.000 (Häufigkeit
bis < 1/10) < 1/100) bis auf
< 1/1.000) Grundlage
der
verfügbaren
Daten nicht
abschätzbar)
Erkrankungen Lymphadeno-
des Blutes und pathiea
des
Lymphsystems
Erkrankungen Überempfindlich- Anaphylaxie
des keitsreaktionen
Immunsystems (z. B. Ausschlag,
Pruritis,
Urtikaria,b
Angioödemb)
Stoffwechsel- verminderter
und Ernährungs- Appetit
störungen
Psychiatrische Schlaflosigkeit
Erkrankungen
Erkrankungen Kopf- Lethargie akute
des schmerzen periphere
Nervensystems Fazialis-
paresec
Herzerkrankung Myokarditis;d
en Perikarditisd
d
Erkrankungen Diarrhö Übelkeit;
des Gastro- Erbrechend
intestinaltrakts
Erkankungen der Hyperhidrose;
Haut und des nächtliche
Unterhautzell- Schweißausbrüche
gewebes
7
Skelettmuskula- Arthralgie; Schmerzen in den
tur-, Bindege- Myalgie Extremitätene
webs- und
Knochen-
erkrankungen
Allgemeine Schmerzen Rötung an Asthenie; Ausgedehnte
Erkrankungen an der der Unwohlsein; Schwellung
und Injektions- Injektions- Jucken an der der geimpften
Beschwerden am stelle; stelle Injektionsstelle Gliedmaße;d
Verabreichungs- Ermüdung; Anschwellen
ort Schüttel- des Gesichtsg
frost;
Fieber;f
Schwellung
an der
Injektions-
stelle
a. Bei Teilnehmern, die eine Auffrischungsdosis (dritte Dosis) erhielten, wurde eine höhere Häufigkeit von
Lymphadenopathie (5,2 % gegenüber 0,4 %) beobachtet als bei Teilnehmern, die 2 Dosen erhielten.
b. Die Häufigkeitskategorie für Urtikaria und Angioödem war „selten“.
c. Während des Verträglichkeitsnachbeobachtungszeitraums der klinischen Studie bis zum 14. November 2020
wurde von vier Teilnehmern in der COVID-19-mRNA-Impfstoffgruppe eine akute periphere Fazialisparese
(oder Gesichtslähmung) berichtet. Der Beginn war am Tag 37 nach Dosis 1 (der Teilnehmer erhielt keine
Dosis 2) und an den Tagen 3, 9 und 48 nach Dosis 2. In der Placebogruppe wurden keine Fälle von akuter
peripherer Fazialisparese (oder Gesichtslähmung) berichtet.
d. Nach der Zulassung erfasste Nebenwirkung.
e. Bezieht sich auf den geimpften Arm.
f. Nach der zweiten Dosis wurde im Vergleich zur ersten Dosis eine höhere Häufigkeit von Fieber beobachtet.
g. Bei Impflingen mit Injektionen dermatologischer Filler in der Anamnese wurde in der Phase nach der
Markteinführung eine Schwellung des Gesichts beobachtet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie
ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über
das in Anhang V aufgeführte nationale Meldesystem anzuzeigen und soweit verfügbar, die
Chargennummer anzugeben.
4.9 Überdosierung
Es liegen Daten zur Überdosierung von 52 Studienteilnehmern der klinischen Studie vor, die aufgrund
eines Verdünnungsfehlers 58 Mikrogramm Comirnaty erhielten. Die Geimpften berichteten nicht über
eine Zunahme der Reaktogenität oder unerwünschte Reaktionen.
Im Falle einer Überdosierung werden eine Überwachung der Vitalfunktionen und eine mögliche
symptomatische Behandlung empfohlen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: andere virale Impfstoffe, ATC-Code: J07BX03
Wirkmechanismus
8

Die Nukleosid-modifizierte Boten-RNA (mRNA) in Comirnaty ist in Lipid-Nanopartikeln formuliert,
die es ermöglichen, die nicht-replizierende RNA in Wirtszellen einzubringen, um die transiente
Expression des SARS-CoV-2 Spike (S)-Antigens zu steuern. Die mRNA kodiert für
membranverankertes S-Protein in voller Länge mit zwei Punktmutationen innerhalb der zentralen
Helix. Die Mutation dieser beiden Aminosäuren zu Prolin fixiert das S-Protein in einer antigenetisch
bevorzugten Prä-Fusions-Konformation. Der Impfstoff löst sowohl neutralisierende Antikörper als
auch zelluläre Immunantworten gegen das Spike (S)-Antigen aus, was zum Schutz gegen COVID-19
beitragen kann.
Wirksamkeit
Die Studie 2 ist eine multizentrische, multinationale, Phase 1/2/3 randomisierte, placebokontrollierte,
beobachterverblindete Dosisfindungs-, Impfstoffkandidatenauswahl- und Wirksamkeitsstudie bei
Teilnehmern ab 12 Jahren. Die Randomisierung wurde nach Alter stratifiziert: 12 bis 15 Jahre, 16 bis
55 Jahre oder 56 Jahre und älter, mit einem Minimum von 40 % der Teilnehmer in der Gruppe der
≥ 56-Jährigen. Ausgeschlossen von der Studie waren Teilnehmer mit geschwächtem Immunsystem
und diejenigen mit vorheriger klinischer oder mikrobiologischer Diagnose von COVID-19.
Teilnehmer mit vorbestehender stabiler Krankheit, definiert als Krankheit, die keine signifikante
Änderung der Therapie oder Krankenhauseinweisung aufgrund Verschlechterung der Krankheit
während der 6 Wochen vor der Teilnahme erforderte, wurden eingeschlossen, ebenso wie Teilnehmer
mit bekannter stabiler Infektion mit dem Humanen Immundefizienz-Virus (HIV), dem Hepatitis C-
Virus (HCV) oder Hepatitis B-Virus (HBV).
Wirksamkeit in Teilnehmern ab 16 Jahre – nach 2 Dosen
Im Phase 2/3-Teil der Studie 2, basierend auf den bis zum 14. November 2020 gesammelten Daten,
wurden ungefähr 44.000 Teilnehmer zu gleichen Teilen randomisiert und erhielten 2 Dosen des
COVID-19-mRNA-Impfstoffs oder Placebo. Die Wirksamkeitsanalysen umfassten Teilnehmer, die
ihre zweite Impfung innerhalb von 19 bis 42 Tagen nach ihrer ersten Impfung erhielten. Die Mehrheit
(93,1 %) der Geimpften erhielt die zweite Dosis 19 bis 23 Tage nach Dosis 1. Es ist geplant, dass die
Teilnehmer bis zu 24 Monate nach der Dosis 2 beobachtet werden, um die Verträglichkeit und
Wirksamkeit gegen COVID-19 zu beurteilen. In der klinischen Studie mussten die Teilnehmer ein
Mindestintervall von 14 Tagen vor und nach der Verabreichung eines Influenza-Impfstoffs einhalten,
um entweder Placebo- oder COVID-19-mRNA-Impfstoff zu erhalten. In der klinischen Studie
mussten die Teilnehmer ein Mindestintervall von 60 Tagen vor oder nach Erhalt von Blut-
/Plasmaprodukten oder Immunglobulinen bis zum Abschluss der Studie einhalten, um entweder
Placebo- oder COVID-19-mRNA-Impfstoff zu erhalten.
Die Population für die Analyse des primären Wirksamkeitsendpunkts umfasste 36.621 Teilnehmer ab
12 Jahren (18.242 in der COVID-19-mRNA-Impfstoffgruppe und 18.379 in der Placebogruppe), die
bis 7 Tage nach der zweiten Dosis keinen Hinweis einer vorherigen Infektion mit SARS-CoV-2
hatten. Außerdem waren 134 Teilnehmer im Alter von 16 bis 17 Jahren (66 in der COVID-19-mRNA-
Impfstoffgruppe und 68 in der Placebogruppe) und 1.616 Teilnehmer 75 Jahre und älter (804 in der
COVID-19-mRNA-Impfstoffgruppe und 812 in der Placebogruppe).
Zum Zeitpunkt der primären Wirksamkeitsanalyse wurden die Teilnehmer über insgesamt
2.214 Personenjahre in der COVID-19-mRNA-Impfstoffgruppe und 2.222 Personenjahre in der
Placebogruppe bezüglich symptomatisches COVID-19 untersucht.
Es gab keine signifikanten klinischen Unterschiede in der Gesamtwirksamkeit des Impfstoffs bei
Teilnehmern mit einem Risiko für schweres COVID-19, einschließlich derjenigen mit einer oder
mehreren Komorbiditäten, die das Risiko für schweres COVID-19 erhöhen (z. B. Asthma, Body-
Mass-Index (BMI) ≥ 30 kg/m2, chronische Lungenerkrankung, Diabetes mellitus, Bluthochdruck).
Die Informationen zur Wirksamkeit des Impfstoffs sind in Tabelle 2 aufgeführt.
9

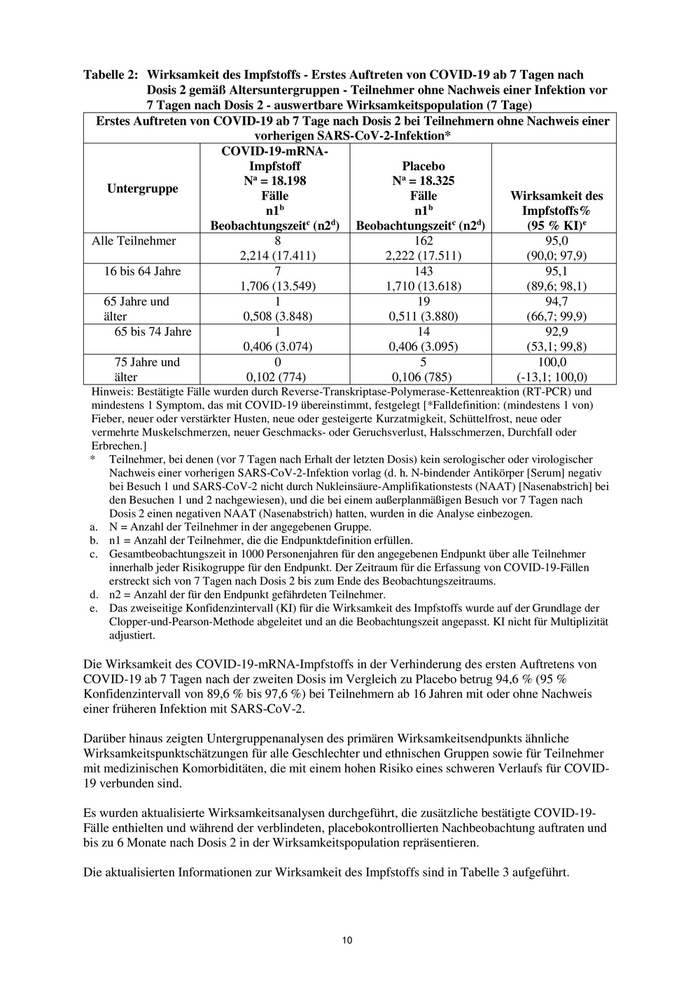
Tabelle 2: Wirksamkeit des Impfstoffs - Erstes Auftreten von COVID-19 ab 7 Tagen nach
Dosis 2 gemäß Altersuntergruppen - Teilnehmer ohne Nachweis einer Infektion vor
7 Tagen nach Dosis 2 - auswertbare Wirksamkeitspopulation (7 Tage)
Erstes Auftreten von COVID-19 ab 7 Tage nach Dosis 2 bei Teilnehmern ohne Nachweis einer
vorherigen SARS-CoV-2-Infektion*
COVID-19-mRNA-
Impfstoff Placebo
Na = 18.198 Na = 18.325
Untergruppe
Fälle Fälle Wirksamkeit des
n1b n1b Impfstoffs%
Beobachtungszeitc (n2d) Beobachtungszeitc (n2d) (95 % KI)e
Alle Teilnehmer 8 162 95,0
2,214 (17.411) 2,222 (17.511) (90,0; 97,9)
16 bis 64 Jahre 7 143 95,1
1,706 (13.549) 1,710 (13.618) (89,6; 98,1)
65 Jahre und 1 19 94,7
älter 0,508 (3.848) 0,511 (3.880) (66,7; 99,9)
65 bis 74 Jahre 1 14 92,9
0,406 (3.074) 0,406 (3.095) (53,1; 99,8)
75 Jahre und 0 5 100,0
älter 0,102 (774) 0,106 (785) (-13,1; 100,0)
Hinweis: Bestätigte Fälle wurden durch Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR) und
mindestens 1 Symptom, das mit COVID-19 übereinstimmt, festgelegt [*Falldefinition: (mindestens 1 von)
Fieber, neuer oder verstärkter Husten, neue oder gesteigerte Kurzatmigkeit, Schüttelfrost, neue oder
vermehrte Muskelschmerzen, neuer Geschmacks- oder Geruchsverlust, Halsschmerzen, Durchfall oder
Erbrechen.]
* Teilnehmer, bei denen (vor 7 Tagen nach Erhalt der letzten Dosis) kein serologischer oder virologischer
Nachweis einer vorherigen SARS-CoV-2-Infektion vorlag (d. h. N-bindender Antikörper [Serum] negativ
bei Besuch 1 und SARS-CoV-2 nicht durch Nukleinsäure-Amplifikationstests (NAAT) [Nasenabstrich] bei
den Besuchen 1 und 2 nachgewiesen), und die bei einem außerplanmäßigen Besuch vor 7 Tagen nach
Dosis 2 einen negativen NAAT (Nasenabstrich) hatten, wurden in die Analyse einbezogen.
a. N = Anzahl der Teilnehmer in der angegebenen Gruppe.
b. n1 = Anzahl der Teilnehmer, die die Endpunktdefinition erfüllen.
c. Gesamtbeobachtungszeit in 1000 Personenjahren für den angegebenen Endpunkt über alle Teilnehmer
innerhalb jeder Risikogruppe für den Endpunkt. Der Zeitraum für die Erfassung von COVID-19-Fällen
erstreckt sich von 7 Tagen nach Dosis 2 bis zum Ende des Beobachtungszeitraums.
d. n2 = Anzahl der für den Endpunkt gefährdeten Teilnehmer.
e. Das zweiseitige Konfidenzintervall (KI) für die Wirksamkeit des Impfstoffs wurde auf der Grundlage der
Clopper-und-Pearson-Methode abgeleitet und an die Beobachtungszeit angepasst. KI nicht für Multiplizität
adjustiert.
Die Wirksamkeit des COVID-19-mRNA-Impfstoffs in der Verhinderung des ersten Auftretens von
COVID-19 ab 7 Tagen nach der zweiten Dosis im Vergleich zu Placebo betrug 94,6 % (95 %
Konfidenzintervall von 89,6 % bis 97,6 %) bei Teilnehmern ab 16 Jahren mit oder ohne Nachweis
einer früheren Infektion mit SARS-CoV-2.
Darüber hinaus zeigten Untergruppenanalysen des primären Wirksamkeitsendpunkts ähnliche
Wirksamkeitspunktschätzungen für alle Geschlechter und ethnischen Gruppen sowie für Teilnehmer
mit medizinischen Komorbiditäten, die mit einem hohen Risiko eines schweren Verlaufs für COVID-
19 verbunden sind.
Es wurden aktualisierte Wirksamkeitsanalysen durchgeführt, die zusätzliche bestätigte COVID-19-
Fälle enthielten und während der verblindeten, placebokontrollierten Nachbeobachtung auftraten und
bis zu 6 Monate nach Dosis 2 in der Wirksamkeitspopulation repräsentieren.
Die aktualisierten Informationen zur Wirksamkeit des Impfstoffs sind in Tabelle 3 aufgeführt.
10