Microsoft Word - CHE-GK-H18-Aufgabe 1_Transparent
Dieses Dokument ist Teil der Anfrage „Abitur-Aufgaben im Fach Chemie im Jahr 2015 in Bremen“
Diese Anfrage wurde als Teil der Kampagne „Frag sie Abi!“ gestellt.
Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Aufgabe 1 Stickoxide und das Ostwald-Verfahren Schwerpunktthemen: Chemisches Gleichgewicht und Protolysegleichgewichte Salpetersäure gehört zu den drei weltweit am häufigsten produzier- ten Säuren und wird großtechnisch nach dem Ostwald-Verfahren hergestellt. Der überwiegende Anteil der Weltproduktion wird zur Herstellung von Düngemitteln (vor allem Ammoniumnitrat) und von Abbildung aus Sprengstoffen verwendet. Aber auch in der Farbstoff- und der urheberrechtlichen Kunststoffindustrie wird Salpetersäure eingesetzt. Wenngleich die Gründen entfernt Säure bereits im neunten Jahrhundert durch trockenes Erhitzen von Salpeter (Kaliumnitrat) mit Vitriol (Kupfersulfat) gewonnen werden konnte, entwickelte erst der deutsche Chemiker Wilhelm Ostwald Anfang des 20. Jahrhunderts ein großtechnisch einsetzbares Syn- Abbildung 1: theseverfahren, das noch heute Anwendung findet. Wilhelm Ostwald Stickstoffmonooxid, der Ausgangsstoff der Salpetersäuresynthese wurde früher unter erhebli- chem Aufwand aus den Elementen gewonnen: Abbildung aus urheberrechtlichen Gründen entfernt Das Gleichgewicht der Reaktion ist temperturabhängig. Die Abhängigkeit des Volumenanteils an Stickstoffmonooxid von der Temperatur ist aus der nebenstehenden Abbildung ersichtlich. Abbildung aus urheberrechtlichen Gründen entfernt Material 1: Synthese von Stickstoffmonooxid aus den Elementen 1. Schritt: Beim Ostwald-Verfahren wird zunächst Ammoniak mit Luftsauerstoff in exothermer Reaktion katalytisch oxidiert: Abbildung aus urheberrechtlichen Gründen entfernt 2. Schritt: Stickstoffmonooxid reagiert mit Sauerstoff in einer Gleichgewichtsreaktion zu Stickstoffdioxid (Schritt 2a) und dieses dimerisiert im Anschluss ebenfalls in einer Gleichgewichtsreaktion zu Distickstofftetraoxid (Schritt 2b). Alle Reaktionsteilnehmer liegen im gasförmigen Zustand vor. 3. Schritt: Im letzten Schritt reagiert das Distickstofftetraoxid in mehreren Teilschritten, die sich in fol- gender Gesamtgleichung zusammenfassen lassen: Abbildung aus urheberrechtlichen Gründen entfernt Material 2: Reaktionsschritte des Ostwald-Verfahrens CHE-GK-H Aufgabe und Erwartungshorizont Seite 1 von 4

Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Salpetersäure findet als Basischemikalie vielfältige Verwendung. In Ludwigshafen befindet sich das größte zusammenhängende Chemieareal der Welt und der größte Verbundstandort der BASF. Die Gesamtzahl der Anlagen, die auf dem seit 1865 existierenden Produktionsge- lände in Betrieb sind, beträgt etwa 200. Abgesehen von der Salpetersäure selbst, wird mit Hilfe von Salpetersäure von Elektrochemikalien für die Halbleiterindustrie über Aromastoffe in Zahncremes bis hin zu Ausgangsstoffen für Lacke, Farben und Klebstoffe und natürlich auch Pflanzenschutz- und Düngemitteln eine ungeheure Vielfalt an Produkten in Ludwigshafen fertiggestellt. Material 3: Informationen zum Verbundstandort Ludwigshafen Aufgaben: 1.1 Erläutern Sie die Begriffe „chemisches Gleichgewicht“ und „Prinzip von Le Chatelier“. Leiten Sie mit Hilfe des Prinzips von Le Chatelier ab, ob es sich bei Reaktion (1) um eine endotherme oder um eine exotherme Reaktion handelt. (8 BE) 1.2 Geben Sie die Reaktionsgleichung für Schritt 2a des Ostwaldverfahrens an. Beurtei- len Sie mit Hilfe des Prinzips von Le Chatelier, wie sich eine Druckveränderung auf die Lage dieser Gleichgewichtsreaktion auswirken würde. (Material 2) (8 BE) 1.3 Geben Sie das Massenwirkungsgesetz für Schritt 2b des Ostwaldverfahrens an. Be- rechnen Sie die Gleichgewichtskonstante Kc, wenn ein Kolben mit einem Volumen von 1 Liter zu Beginn mit 0,2 mol Stickstoffdioxid befüllt war und sich nach Einstel- lung des Gleichgewichts 0,059 mol Distickstofftetraoxid und 0,086 mol Stickstoffdioxid im Gefäß befinden. (Material 2) (7 BE) 1.4 Begründen Sie, weshalb die Errichtung von Verbundstandorten sinnvoll ist. Geben Sie fünf unterschiedliche Aspekte an. (Material 3) (7 BE) CHE-GK-H Aufgabe und Erwartungshorizont Seite 2 von 4

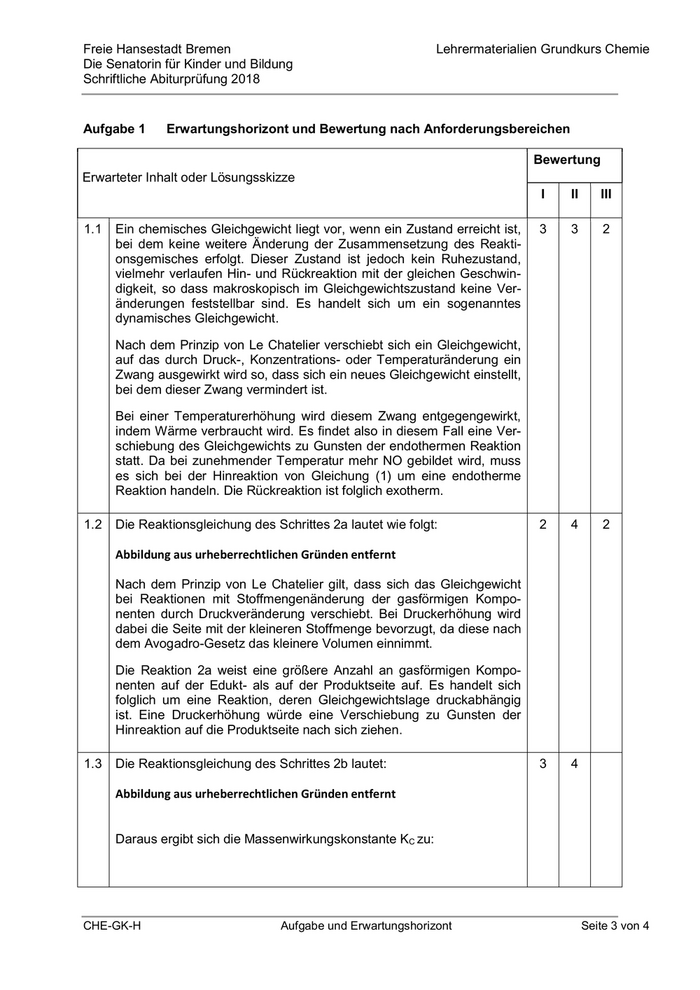
Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Aufgabe 1 Erwartungshorizont und Bewertung nach Anforderungsbereichen Bewertung Erwarteter Inhalt oder Lösungsskizze I II III 1.1 Ein chemisches Gleichgewicht liegt vor, wenn ein Zustand erreicht ist, 3 3 2 bei dem keine weitere Änderung der Zusammensetzung des Reakti- onsgemisches erfolgt. Dieser Zustand ist jedoch kein Ruhezustand, vielmehr verlaufen Hin- und Rückreaktion mit der gleichen Geschwin- digkeit, so dass makroskopisch im Gleichgewichtszustand keine Ver- änderungen feststellbar sind. Es handelt sich um ein sogenanntes dynamisches Gleichgewicht. Nach dem Prinzip von Le Chatelier verschiebt sich ein Gleichgewicht, auf das durch Druck-, Konzentrations- oder Temperaturänderung ein Zwang ausgewirkt wird so, dass sich ein neues Gleichgewicht einstellt, bei dem dieser Zwang vermindert ist. Bei einer Temperaturerhöhung wird diesem Zwang entgegengewirkt, indem Wärme verbraucht wird. Es findet also in diesem Fall eine Ver- schiebung des Gleichgewichts zu Gunsten der endothermen Reaktion statt. Da bei zunehmender Temperatur mehr NO gebildet wird, muss es sich bei der Hinreaktion von Gleichung (1) um eine endotherme Reaktion handeln. Die Rückreaktion ist folglich exotherm. 1.2 Die Reaktionsgleichung des Schrittes 2a lautet wie folgt: 2 4 2 Abbildung aus urheberrechtlichen Gründen entfernt Nach dem Prinzip von Le Chatelier gilt, dass sich das Gleichgewicht bei Reaktionen mit Stoffmengenänderung der gasförmigen Kompo- nenten durch Druckveränderung verschiebt. Bei Druckerhöhung wird dabei die Seite mit der kleineren Stoffmenge bevorzugt, da diese nach dem Avogadro-Gesetz das kleinere Volumen einnimmt. Die Reaktion 2a weist eine größere Anzahl an gasförmigen Kompo- nenten auf der Edukt- als auf der Produktseite auf. Es handelt sich folglich um eine Reaktion, deren Gleichgewichtslage druckabhängig ist. Eine Druckerhöhung würde eine Verschiebung zu Gunsten der Hinreaktion auf die Produktseite nach sich ziehen. 1.3 Die Reaktionsgleichung des Schrittes 2b lautet: 3 4 Abbildung aus urheberrechtlichen Gründen entfernt Daraus ergibt sich die Massenwirkungskonstante KC zu: CHE-GK-H Aufgabe und Erwartungshorizont Seite 3 von 4
Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Abbildung aus urheberrechtlichen Gründen entfernt Durch Einsetzen der vorgegebenen Gleichgewichtskonzentrationen erhält man mit Abbildung aus urheberrechtlichen Gründen entfernt Abbildung aus urheberrechtlichen Gründen entfernt 1.4 Im Verbund werden Produktionsanlagen, Energiefluss, Logistik und 4 3 Infrastruktur miteinander vernetzt. Daraus ergeben sich unter anderem folgende Vorteile: effiziente Produktionsanlagen: bspw. die Abwärme aber auch Nebenprodukte aus einem Produktionsprozess können in ei- nem anderen Prozess am Standort genutzt werden die Infrastruktur muss nicht an vielen Einzelstandorten aufge- baut werden, sondern kann von jedem Betrieb am Standort genutzt werden Kostenersparnis bei der Abfallaufbereitung aber auch bei der Entsorgung Entlastung der Umwelt durch die Vermeidung langer Trans- portwege gezieltere Steuerung der Produktion und Möglichkeit flexibler auf Anforderungen des Marktes zu reagieren durch Vernetzung der Fabriken in einem Verbund ständiger Wissensaustausch möglich, da das Knowhow vieler Mitarbeiter an einem Standort verknüpft wird Alternative Argumente sind möglich. 8 15 7 Quellen: Bild: http://daten.didaktikchemie.uni-bayreuth.de/umat/ostwald/ostwald.htm (letzter Zugriff: Januar 2018) Informationen: https://www.basf.com/de/company/investor-relations/basf-at-a-glance/verbund.html (letzter Zugriff: Januar 2018) Asselborn, W./Jäckel, M./Risch, Dr. K.T. (Hrsg.): Chemie heute SII Gesamtband, Bildungs- haus Schulbuchverlage, Braunschweig 2009 Riedel, E./Janiak, C.: Anorganische Chemie, De Gruyter; 9. Auflage, Berlin 2015 CHE-GK-H Aufgabe und Erwartungshorizont Seite 4 von 4




