Microsoft Word - CHE-GK-H18-Aufgabe 2 Transparent
Dieses Dokument ist Teil der Anfrage „Abitur-Aufgaben im Fach Chemie im Jahr 2015 in Bremen“
Diese Anfrage wurde als Teil der Kampagne „Frag sie Abi!“ gestellt.
Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Aufgabe 2 Ameisensäure zur Bekämpfung der Varroa-Milbe Schwerpunktthema: Protolysegleichgewichte Abbildung aus Bienen leiden häufig unter dem Befall durch die Varroamilbe, die urheberrechtlichen aus Asien eingeschleppt wurde. Die 1,7 Millimeter kleine Milbe Gründen entfernt ernährt sich vom Blut der Bienen. Über die Bisswunden können zusätzlich Viren auf die Biene übertragen werden, die eine Deformation der Flügel hervorrufen. Die Milbe befällt auch die Bienenlarven. Diese sind dann schon beim Schlüpfen aus den Abb. 1: Varroa-Milbe Waben geschwächt und sterben oft schon kurz danach. Imker setzen natürlich vorkommende organische Säuren wie Behandlung der Bienen Ameisensäure (Methansäure), Milchsäure oder Oxalsäure zur Bekämpfung der Milben ein. Die Milben sterben beim Kontakt mit der Säure ab. Bei korrekter Behandlung werden die Bienen Abbildung aus hingegen nicht geschädigt. Die Ameisensäure kommt z.B. im urheberrechtlichen Gründen Sekret der Ameisen, in Brennnesseln oder dem Gift von Bienen entfernt und Quallen vor. Sie kommt auch natürlich in geringen Mengen im Bienenhonig vor. Gegen die Varroamilbe kann der Imker eine 60 % ige Ameisensäurelösung kaufen. Das Bedampfen mit Ameisensäure Ameisensäure ist die einzige Möglichkeit auch die Larven in den Bienenwaben zu behandeln. Dazu wird die Ameisensäure Formel: HCOOH in einen speziellen Verdampfer gegeben oder ein Schwammtuch wird mit einer Spritze mit Ameisensäure Gefahrensymbol: getränkt (siehe Abbildung) und auf oder unter den Bienenkasten gelegt. Die Behandlung der Bienen muss im Winter außerhalb der Abbildung aus Brutsaison nach der letzten Honigernte erfolgen. Die urheberrechtlichen Gründen Ameisensäurekonzentration im Honig ist dann im entfernt darauffolgenden Frühling geringfügig erhöht. Jedoch ist keine Veränderung des Honiggeschmacks festzustellen und es werden auch keine Grenzwerte überschritten. Der Behandlungszeitraum ist unbedingt einzuhalten, da es sonst zu höheren Rückständen an Ameisensäure im Honig kommt. Konzentration der Lösung: 60 % m/V (Masse pro Volumen) Material 1: Ameisensäuren zur Bekämpfung der Varroamilbe Indikator pH-Bereich des Farbumschlags Farbänderung Thymolblau 1,2 - 2,8 rot - gelb Methylorange 3,2 - 4,4 rot - gelb Methylrot 4,8 - 6,0 rot - gelb Thymolblau 8,0 - 9,6 gelb - blau Phenolphthalein 8,2 - 10,0 farblos - purpur Epsilonblau 12,0 -13,0 orange - violett Material 2: Umschlagsbereiche verschiedener pH-Indikatoren CHE-GK-H Aufgabe und Erwartungshorizont Seite 1 von 4
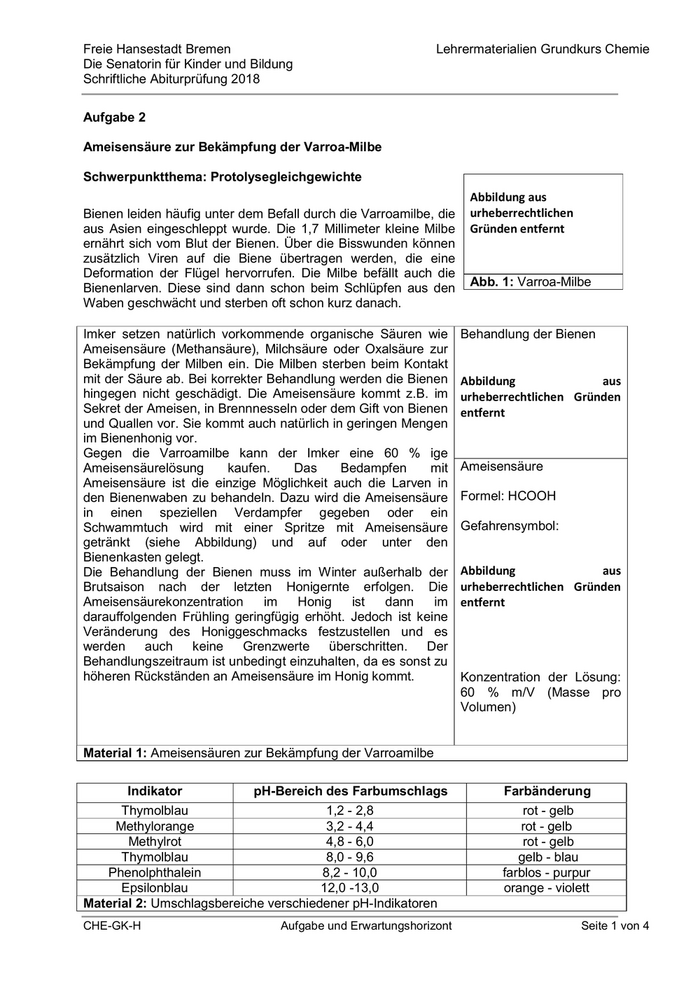
Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Zur Bestimmung des Ameisensäuregehalts der Behandlungslösung wurde eine Probe verdünnt und gegen Natronlauge titriert. Es wurde die folgende Titrationskurve erhalten. Material 3: Titrationskurve von Ameisensäure mit Natronlauge Aufgaben: 2.1 Beschreiben Sie das experimentelle Vorgehen bei der Titration einer Ameisensäurelösung mit Natronlauge. (4 BE) 2.2 Erklären Sie allgemein die Bedeutung des pKs-Wertes und bestimmen Sie graphisch den Äquivalenzpunkt und den pKs-Wert. Erklären Sie den Verlauf der Titrationskurve und begründen Sie, welchen Indikator Sie für die Titration wählen würden. (Material 2 und 3) (11 BE) 2.3 Geben Sie die Formelgleichung für die Umsetzung der Ameisensäurelösung mit Natronlauge an und berechnen Sie das Volumen der Natronlauge (c = 1 mol/l), das bei der Titration einer 5 ml-Probe der Ameisensäurelösung verbraucht wird. (Material 1) (7 BE) 2.4 Begründen Sie, welche Schutzmaßnahmen der Imker beim Umgang mit Ameisensäure treffen muss und nehmen Sie Stellung, ob der von behandelten Bienen erzeugte Honig noch als „Honig ohne fremde Zusätze“ verkauft werden darf. (Material 1) (8 BE) CHE-GK-H Aufgabe und Erwartungshorizont Seite 2 von 4
Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Aufgabe 2 Erwartungshorizont und Bewertung nach Anforderungsbereichen Bewertung Erwarteter Inhalt oder Lösungsskizze I II III 2.1 Eine Bürette wird über einen Trichter mit Natronlauge blasenfrei 4 befüllt. In einem Erlenmeyerkolben wird eine bestimmte Menge der Ameisensäurelösung vorgelegt und mit Indikator versetzt. Unter ständigem Schwenken des Erlenmeyerkolbens oder Rühren mit dem Magnetrührer wird tropfenweise Natronlauge bis zum Farbumschlag zugegeben. Der Verbrauch an Natronlauge wird an der Bürette abgelesen. Die Beschreibung der Aufnahme einer Titrationskurve mit einem pH- Meter ist auch richtig. 2.2 Der pKs-Wert ist der negative dekadische Logarithmus der 3 8 Säurekonstante Ks und gibt die Stärke einer Säure an. Je größer die Säurekonstante Ks, desto niedriger ist der pKs-Wert und desto stärker ist die Säure. Bei einer großen Säurekonstante liegt das Protolysegleichgewicht weit auf der Seite der korrespondierenden Base. Der Äquivalenzpunkt liegt bei pH = 8,2 und 10 ml zugegebener Natronlauge. Der pKs-Wert am Halbäquivalenzpunkt liegt bei pH = 3,8 und 5 ml zugegebener Natronlauge. Zunächst steigt die Kurve an, da ein Teil der Ameisensäure mit der Natronlauge zu Natriumformiat (HCOONa) reagiert. Um den pKs-Wert ändert sich der pH-Wert kaum, da ein Puffer aus Ameisensäure und Natriumformiat vorliegt. Schließlich ist jedoch die Pufferkapazität erschöpft und es ist am Äquivalenzpunkt bei 10 ml ist ein markanter Anstieg des pH-Wertes zu beobachten. Die Säure liegt nun vollständig deprotoniert vor. Da die Titrationskurve am Äquivalenzpunkt den steilen Anstieg der Kurve im basischen Bereich aufweist, muss ein Indikator mit Umschlagspunkt im Basischen verwendet werden. Es kommen also Phenolphthalein und Thymolblau in Frage. Epsilonblau schlägt zwar auch im Basischen um, ist aber dennoch nicht geeignet, da der Indikator erst zwischen pH = 12 und 13 im flachen Bereich der Titrationskurve umschlägt. 2.3 HCOOH + NaOH HCOONa + H2O 2 4 1 Gegeben: M(HCOOH) = 46,03 g/mol; V(HCOOH) = 5 ml; c(NaOH) = 1 mol/l Konzentration: 60 % 60 g pro 100 ml c(HCOOH) = Gesucht: V(NaOH) CHE-GK-H Aufgabe und Erwartungshorizont Seite 3 von 4
Freie Hansestadt Bremen Lehrermaterialien Grundkurs Chemie Die Senatorin für Kinder und Bildung Schriftliche Abiturprüfung 2018 Es werden 65 ml NaOH zur Titration von 5 ml der Ameisensäurelösung verbraucht. 2.4 Der Imker sollte eine Schutzbrille und Schutzhandschuhe tragen, da er 1 3 4 sich sonst die Augen und die Haut verätzen könnte. Vor allem beim Hantieren mit der Spritze könnte etwas danebenspritzen bei unsachgemäßer Handhabung oder falls die Spritze defekt ist. Es ist auch ratsam einen Eimer mit Wasser bereitzustellen, um eventuell betroffene Hautstellen schnellstmöglich zu reinigen. Der Honig von behandelten Bienen kann als „Honig ohne fremde Zusätze“ verkauft werden, da es sich bei Ameisensäurelösung zwar um eine Chemikalie handelt, die in der Fabrik künstlich hergestellt wurde, aber sie kommt auch natürlich z.B. in Brennnesseln und selbst im Bienengift vor. Außerdem kommen auch natürlicherweise im Bienenhonig geringe Mengen an Ameisensäure vor. Im behandelten Honig ist der Ameisensäuregehalt zwar geringfügig erhöht, aber es kommt zu keiner geschmacklichen Veränderung und es werden auch keine Grenzwerte überschritten. Allerdings muss ein bestimmter Zeitraum zur Behandlung eingehalten werden, da der Honig sonst erhöhte Mengen an Ameisensäure aufweisen könnte. Alternative Lösungen und anderslautende Argumentationen sind auch möglich. 10 15 5 Quellen: Bilder: https://commons.wikimedia.org/w/index.php?curid=10247938 (letzter Zugriff: Januar 2018) http://www.members.aon.at/harald_schrenk/downloads/VB_AS_Info.pdf (letzter Zugriff: Januar 2018) Informationen: Titrationskurve der Ameisensäure selbst erstellt nach den Werten aus Brückl, Edgar; Prof. Eisner, Werner et al.: Elemente Chemie 2, Ernst Klett Verlag, Stuttgart, 2010, S.219 (Abbildung bearbeitet) https://www.andermatt- biovet.de/media/downloads/1069/Sicherheitsdatenblatt_FORMIVAR_60__DE.pdf. http://www.chemieunterricht.de/dc2/indikator/indi02a.htm (letzter Zugriff: Januar 2018) http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/11/aac/vorlesung/kap_10/vlu/sb_indikato ren.vlu/Page/vsc/de/ch/11/aac/vorlesung/kap_10/kap10_9/kap10_9b.vscml.html (letzter Zugriff: Januar 2018) https://www.agroscope.admin.ch/dam/agroscope/en/dokumente/themen/nutztiere/bienen/sen s98.pdf.download.pdf/sens98_e.pdf (letzter Zugriff: Januar 2018) CHE-GK-H Aufgabe und Erwartungshorizont Seite 4 von 4




