lllllllllllll
Dieses Dokument ist Teil der Anfrage „Abitur-Aufgaben im Fach Chemie im Jahr 2015 in Bremen“
Diese Anfrage wurde als Teil der Kampagne „Frag sie Abi!“ gestellt.
Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Aufgabe 1 Textilfasern - Natürliche und synthetische Polyamide Schwerpunktthema: Naturstoffe Textilien in den verschiedensten Formen gehören zu den ältesten Produkten, die seit der Frühzeit der Menschheit hergestellt werden. Hauptbestandteile aller textilen Erzeugnisse Die Abbildung wurde Die Abbildung wurde aus sind Fasern, die verspinnbar sein müssen. aus urheberrechtlichen urheberrechtlichen Grundsätzlich unterscheidet man zwischen Gründen entfernt. Gründen entfernt. Natur- und Chemiefasern. Während zur ers- ten Fasergruppe tierische und pflanzliche Abbildung 1: Schaf und Seidenraupen als Roh- Fasern zählen, die beispielsweise aus Ami- stoffproduzenten von Wolle und Seide nosäuren aufgebaut sind, werden unter dem Begriff Chemiefasern diejenigen textilen Fasern zusammengefasst, die aus Rohstoffen wie Erdöl, Erdgas oder Kohle produziert werden. Spielten bis vor ungefähr einhundert Jahren ausschließlich Naturfasern wie Seide oder Schafwolle eine tragende Rolle in der Textilwirtschaft, kommt heute synthetischen Fasern wie Polyestern oder Polyamiden eine große Bedeutung zu. Seide besteht zu über 80% aus den Aminosäuren Glycin, Alanin und Serin. Hauptbestandteil der Seide ist das Protein Fibroin. Die dominierende, sich wiederholende Aminosäuresequenz in Fib- roin ist Gly-Ser-Gly-Ala-Gly-Ala. Material 1: Zusammensetzung und Aufbau von Seide Die Abbildung wurde aus urheberrechtlichen Gründen Die Abbildung wurde aus urheberrechtlichen Gründen entfernt. entfernt. Sekundärstruktur 1 Sekundärstruktur 2 In dieser Sekundärstruktur liegen die Restgruppen (R) ins- gesamt relativ dicht beieinander, so dass größere Reste die Anordnung stören. So liegen die Proteinketten der Sei- de ausschließlich in dieser Sekundärstruktur vor. Material 2: Sekundärstrukturen in Proteinen CHE-GK-H Aufgabe 1 Seite 1 von 18

Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Wolle und Seide sind die wichtigsten Proteinfasern und besitzen charakteristische Eigenschaften: Wollfasern sind stark dehnbar und elastisch: Wenn die Zugbelastung nachlässt, kehren die Fasern in die Ausgangslage zurück. Andererseits sind die Fasern nur mäßig reißfest. Charakteristische Merkmale der Seide sind eine ungewöhnliche Reißfestigkeit und eine geringe Dehnbarkeit. Wenn an einem Seidenfaden gezogen wird, dann dehnt dieser sich nicht, sondern widersetzt sich zunächst der Ausdehnung, bis er letztendlich reißt. Material 3: Eigenschaften von Seide und Wolle im Vergleich Die Abbildung wurde aus urheberrechtlichen Gründen entfernt. Synthetische Polyamide werden in immer größeren Mengen produziert. Wie bei den Proteinen entstehen auch die synthetischen Polyamide unter Wasserabspaltung aus Monomeren. Die erste Faser, die vollständig synthetisch hergestellt wurde, war Nylon (die Abbildung zeigt die sich in der Nylonfaser wiederholende, aus zwei Monomeren aufgebaute Sequenz). Die maximale Was- seraufnahme liegt bei ca. 3%. Daher trocknet Nylongewebe relativ schnell nach dem Waschen. Wolle, die aus vielen verschiedenen Aminosäuren aufgebaut ist, nimmt 14 bis 15 % Wasser auf. Material 4: Informationen zu Nylon und Ausschnitt aus der Strukturformel Aufgaben 1.1 Erklären Sie anhand einer allgemeinen Strukturformel den Aufbau eines -Aminosäure- moleküls (bzw. 2-Aminosäuremolekül). Zeichnen Sie die Aminosäuresequenz Gly-Ser-Gly- Ala-Gly-Ala aus dem Seidenprotein Fibroin in Strukturformeln (Anhang). (08 BE) 1.2 Benennen und beschreiben Sie unter Berücksichtigung zwischenmolekularer Kräfte die Se- kundärstrukturen bei Proteinen in Material 2. (08 BE) 1.3 Begründen Sie unter Berücksichtigung der Restgruppengrößen das Auftreten der Sekun- därstruktur 2 bei Seidenfasern. Entwickeln Sie eine Hypothese zur Sekundärstruktur von Wolle. Erläutern Sie mithilfe der Sekundärstrukturen die Dehnbarkeit und Reißfestigkeit von Seide und Wolle (Material 2-3). (07 BE) 1.4 Geben Sie die Strukturformeln der Monomere an, aus denen Nylon gebildet wird. Erklären Sie anhand der Strukturen die im Vergleich zu Wolle geringere Fähigkeit von Nylon, Wasser zu binden (Material 4). (07 BE) CHE-GK-H Aufgabe 1 Seite 2 von 18

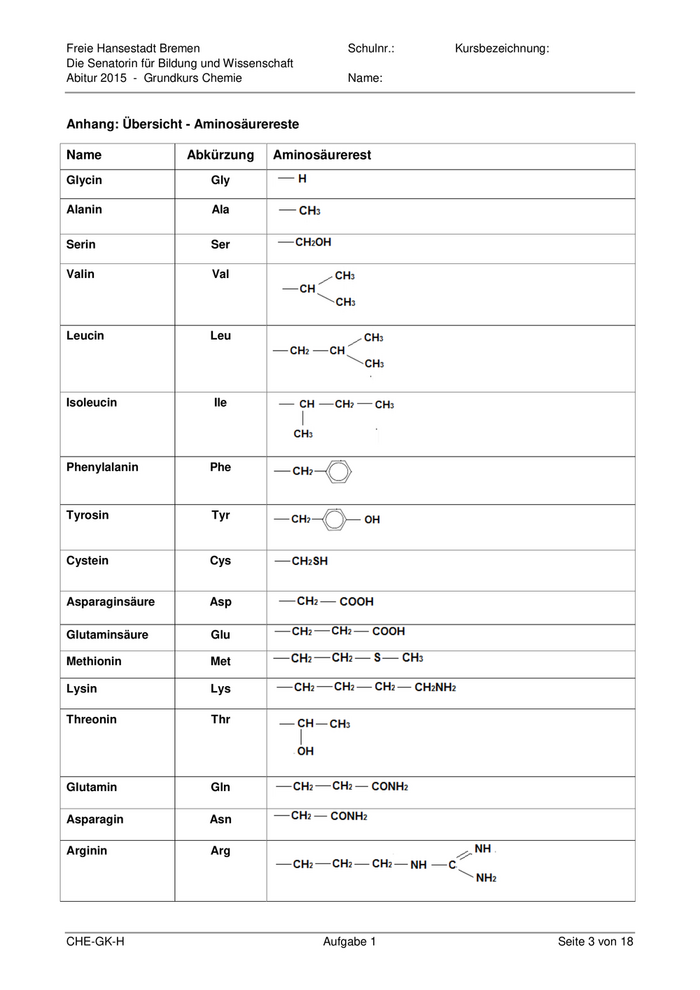
Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Anhang: Übersicht - Aminosäurereste Name Abkürzung Aminosäurerest Glycin Gly Alanin Ala Serin Ser Valin Val Leucin Leu Isoleucin Ile Phenylalanin Phe Tyrosin Tyr Cystein Cys Asparaginsäure Asp Glutaminsäure Glu Methionin Met Lysin Lys Threonin Thr Glutamin Gln Asparagin Asn Arginin Arg CHE-GK-H Aufgabe 1 Seite 3 von 18
Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Aufgabe 2 Die Chemie des Honigs Schwerpunktthema: Naturstoffe Bienenhonig ist ein Naturprodukt. Bisher wurden 245 natürli- Die Abbildung wurde aus che Substanzen in verschiedenen Honigsorten nachgewiesen. urheberrechtlichen Gründen Honig wird als Süßungsmittel oder Süßigkeit, aber vor allem entfernt. als Brotaufstrich eingesetzt. Zu diesem Zweck hat man bereits im 19. Jahrhundert versucht eine günstigere, industriell her- Abbildung 1: Honigproduzent stellbare Alternative zu Bienenhonig zu entwickeln. Anfang Biene des 20. Jahrhunderts war aromatisierter Kunsthonig mit Ho- nigzusatz dann schon weit verbreitet. Kunsthonig ist eine zähflüssige Masse aus invertierter Sac- charose. In Deutschland ist seit 1977 der Begriff "Kunsthonig" in der Produktkennzeichnung nicht mehr er- laubt, stattdessen muss der Ausdruck „Invertzuckercreme“ verwendet werden, um eine Täuschung des Verbrauchers zu vermeiden. In einem Becherglas werden 70 g Haushaltszucker in 100 ml Wasser unter Rühren gelöst. Nach Zugabe Die Abbildung wurde aus einer wässrigen Citronensäure-Lösung erhitzt man urheberrechtlichen Gründen entfernt. ca. 1 Stunde unter Rühren und lässt die Lösung dann abkühlen. Aus der zunächst farblosen Flüssigkeit entsteht beim Erhitzen eine gelbe viskose Masse: Kunsthonig. Es hat eine Inversion der Saccharose stattgefunden, bei der die Saccharose unter dem katalytischen Einfluss der Säure hydrolysiert wird. Als Reaktionsprodukte entstehen Glucose und Fructose. Material 1: Experiment zur Herstellung von Kunsthonig und Strukturformel von Saccharose Bestandteil Prozentualer Anteil Mit folgendem Experiment kann man Kunst- Wasser 17,2 honig und natürlichen Honig unterscheiden: Fructose 38,2 Zu einer Probe Kunsthonig und einer Probe Glucose 31,3 natürlichem Honig wird etwas Stärkelösung Saccharose 1,3 gegeben. Man lässt die Lösungen eine Maltose 7,3 Stunde im Wasserbad bei 40 °C stehen. Höhere Zucker 1,5 Anschließend gibt man einige Tropfen Sonstiges: Enzyme, 2 Iod/Kaliumiodid-Lösung dazu. Vitamine, Aromastoffe Säuren 0,6 Mineralstoffe 0,17 In natürlichem Honig sind verschiedene Enzyme ent- halten u.a. auch die Amylase. Dieses Enzym kann Polysaccharide wie Stärke in das Disaccharid Malto- se aufspalten. Material 2: Zusammensetzung von Honig (exempla- Material 3: Experiment zur Unterscheidung risch) und Informationen zu Amylase von Honig und Kunsthonig CHE-GK-H Aufgabe 2 Seite 4 von 18

Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Die Inversion von Saccharose lässt sich mit Hilfe der Polarimetrie verfolgen. Der Drehwinkel der Lösung wurde im Verlauf der Reaktion gemessen. Die Abbildung wurde aus urheberrechtlichen Gründen entfernt. Der Drehwinkel errechnet sich aus dem spezifischen Drehwinkel sp, der Massenkonzentration und der Länge der Messzelle l . asp l Stoff (wässrige Lösung) D-Glucose D-Fructose Saccharose spezifischer Drehwinkel +53 -92 +66,5 3 in (grd cm )/(g dm) Material 4: Versuchsauswertung zur Inversion von Saccharose und spezifische Drehwinkel von Glucose, Fructose und Saccharose Aufgaben 2.1 Geben Sie für die saure Hydrolyse von Saccharose (Inversion) die Reaktionsgleichung in Haworth-Projektionsformeln an und benennen Sie die Produkte (Material 1). Vergleichen Sie die Zusammensetzung von natürlichem Honig und Kunsthonig (Material 1 und 2). (07 BE) 2.2 Erläutern Sie die Iod-Stärke-Probe. Entwickeln Sie eine Hypothese über das Versuchser- gebnis in Material 3 (Material 2). (05 BE) 2.3 Erläutern Sie anhand eines selbst gewählten Beispiels die Begriffe "optische Aktivität" und "D/L-Konfiguration" bei Kohlenhydraten unter Angabe der Fischer-Projektionsformeln. (08 BE) 2.4 Erklären Sie den Kurvenverlauf in Material 4. Begründen Sie, ob die Tollensprobe als Nach- weis für die Inversion von Saccharose angewendet werden kann (Material 1). (10 BE) CHE-GK-H Aufgabe 2 Seite 5 von 18

Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Aufgabe 3 Katalytische Prozesse in der Industrie – Erdölverarbeitung Schwerpunktthema: Reaktionskinetik und Katalyse In der chemischen Industrie nimmt das Erdöl als Rohstoff eine bedeutende Stellung ein. Die meis- ten chemischen Erzeugnisse lassen sich aus ca. 300 Grundchemikalien aufbauen, die heute zu ca. 90 % aus Erdöl und Erdgas gewonnen werden können. Erdöl ist ein Gemisch aus mehreren hundert ver- schiedenen Kohlenwasserstoffen. Durch fraktionier- te Destillation kann das Erdöl in Fraktionen von Kohlenwasserstoffgemischen mit charakteristischen Die Abbildung wurde aus Siedebereichen zerlegt werden. urheberrechtlichen Gründen entfernt. Ein Vergleich zwischen Angebot und Nachfrage für die einzelnen Erdölfraktionen zeigt ein Missverhält- nis auf. Erdöl enthält relativ große Mengen an lang- kettigen, hoch siedenden Fraktionen und zu wenig der kurzkettigen, niedrig siedenden Fraktionen wie zum Beispiel Benzin (Abbildung 1). Durch technische Prozesse wie Cracken, Isomeri- sierung und Hydrierung lassen sich jedoch aus den weniger benötigten Fraktionen große Mengen der Abbildung 1: Fraktionen des Erdöls – Vor- benötigten Erdölkomponenten herstellen. Bei die- kommen (exemplarisch Zusammensetzung sen Prozessen spielen Katalysatoren eine ent- des Erdöls aus der Nordsee) und Bedarf scheidende Rolle. Die Abbildung wurde aus urheberrechtlichen Gründen entfernt. Um der Nachfrage an niedrig siedenden Fraktionen nachzukommen, werden hoch siedende Koh- lenwasserstoffe durch Cracken in niedrig siedende überführt. Ein wichtiges Produkt beim Cracken ist zum Beispiel Ethen. Material 1: Vereinfachtes Schema einer katalytischen Crack-Anlage CHE-GK-H Aufgabe 3 Seite 6 von 18

Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Die Abbildung wurde aus urheberrechtlichen Gründen entfernt. Material 2: Mechanismus der katalytischen Hydrierung von Ethen Ein wichtiger Faktor für die Reaktions- geschwindigkeit bei der Hydrierung von Ethen an einer Katalysatoroberoberfläche ist das Ver- hältnis der Konzentrationen von Wasserstoff und Ethen. Variiert man bei konstanter Ethen- Die Abbildung wurde aus urheberrechtlichen konzentration die Konzentration an Wasser- Gründen entfernt. stoff, so ergibt sich für die Hydrierung von Ethen an einer Metalloberfläche folgendes Er- gebnis: Material 3 : Reaktionsgeschwindigkeit der Metall-katalysierten Hydrierung von Ethen Aufgaben 3.1 Stellen Sie die Schritte beim katalytischen Cracken in einer großindustriellen Anlage dar (Ma- terial 1). Erläutern Sie anhand eines selbstgewählten Beispiels unter Verwendung von Struk- turformeln die Synthese von Ethen aus einem langkettigen Alkan. (10 BE) 3.2 Beschreiben Sie die Vorgänge bei der Hydrierung von Ethen an der Katalysatoroberfläche (Material 2) und erklären Sie anhand dieses Beispiels den Begriff „heterogene Katalyse“. (06 BE) 3.3 Zeichnen Sie eine grafische Darstellung der Maxwell-Boltzmann-Geschwindigkeitsverteilung. Erläutern Sie mithilfe der Grafik die Auswirkung eines Katalysators auf eine chemische Reak- tion. (06 BE) 3.4 Beschreiben Sie die Grafik in Material 3. Stellen Sie eine Hypothese zur Entwicklung der Reaktionsgeschwindigkeit in Abhängigkeit von der Wasserstoffkonzentration unter Berück- sichtigung des Hydrierungsmechanismus auf (Material 2 und 3). (08 BE) Aufgabe 4 Milch - Enzyme bestimmen die Qualität Schwerpunktthema: Reaktionskinetik und Katalyse CHE-GK-H Aufgabe 3 Seite 7 von 18

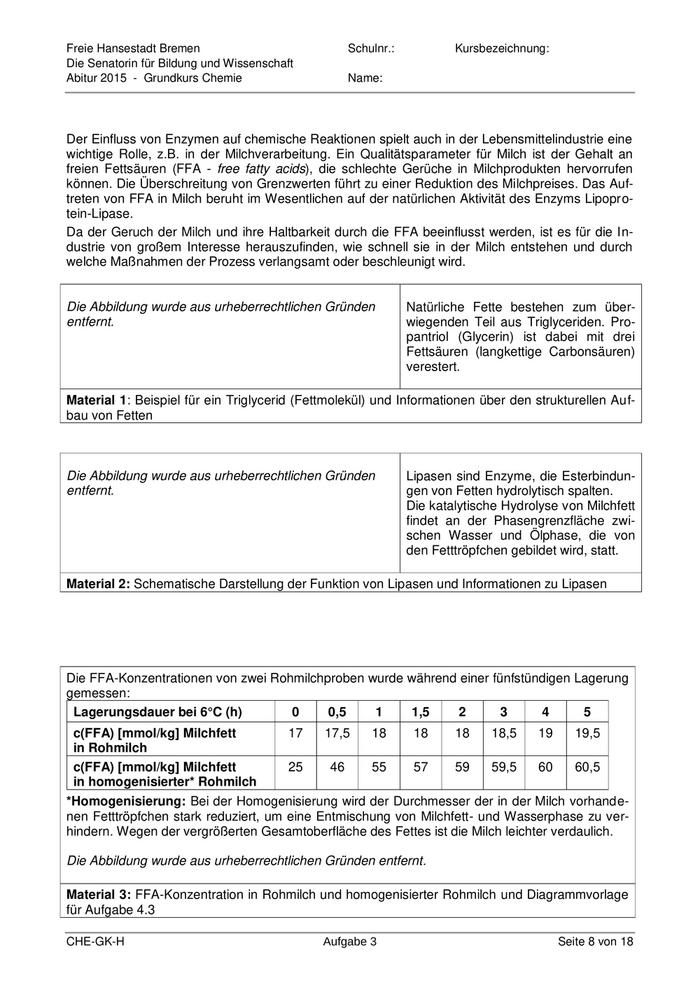
Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Der Einfluss von Enzymen auf chemische Reaktionen spielt auch in der Lebensmittelindustrie eine wichtige Rolle, z.B. in der Milchverarbeitung. Ein Qualitätsparameter für Milch ist der Gehalt an freien Fettsäuren (FFA - free fatty acids), die schlechte Gerüche in Milchprodukten hervorrufen können. Die Überschreitung von Grenzwerten führt zu einer Reduktion des Milchpreises. Das Auf- treten von FFA in Milch beruht im Wesentlichen auf der natürlichen Aktivität des Enzyms Lipopro- tein-Lipase. Da der Geruch der Milch und ihre Haltbarkeit durch die FFA beeinflusst werden, ist es für die In- dustrie von großem Interesse herauszufinden, wie schnell sie in der Milch entstehen und durch welche Maßnahmen der Prozess verlangsamt oder beschleunigt wird. Die Abbildung wurde aus urheberrechtlichen Gründen Natürliche Fette bestehen zum über- entfernt. wiegenden Teil aus Triglyceriden. Pro- pantriol (Glycerin) ist dabei mit drei Fettsäuren (langkettige Carbonsäuren) verestert. Material 1: Beispiel für ein Triglycerid (Fettmolekül) und Informationen über den strukturellen Auf- bau von Fetten Die Abbildung wurde aus urheberrechtlichen Gründen Lipasen sind Enzyme, die Esterbindun- entfernt. gen von Fetten hydrolytisch spalten. Die katalytische Hydrolyse von Milchfett findet an der Phasengrenzfläche zwi- schen Wasser und Ölphase, die von den Fetttröpfchen gebildet wird, statt. Material 2: Schematische Darstellung der Funktion von Lipasen und Informationen zu Lipasen Die FFA-Konzentrationen von zwei Rohmilchproben wurde während einer fünfstündigen Lagerung gemessen: Lagerungsdauer bei 6°C (h) 0 0,5 1 1,5 2 3 4 5 c(FFA) [mmol/kg] Milchfett 17 17,5 18 18 18 18,5 19 19,5 in Rohmilch c(FFA) [mmol/kg] Milchfett 25 46 55 57 59 59,5 60 60,5 in homogenisierter* Rohmilch *Homogenisierung: Bei der Homogenisierung wird der Durchmesser der in der Milch vorhande- nen Fetttröpfchen stark reduziert, um eine Entmischung von Milchfett- und Wasserphase zu ver- hindern. Wegen der vergrößerten Gesamtoberfläche des Fettes ist die Milch leichter verdaulich. Die Abbildung wurde aus urheberrechtlichen Gründen entfernt. Material 3: FFA-Konzentration in Rohmilch und homogenisierter Rohmilch und Diagrammvorlage für Aufgabe 4.3 CHE-GK-H Aufgabe 3 Seite 8 von 18
Freie Hansestadt Bremen Schulnr.: Kursbezeichnung: Die Senatorin für Bildung und Wissenschaft Abitur 2015 - Grundkurs Chemie Name: Aufgaben 4.1 Erläutern Sie die Wirkung von Enzymen auf die Geschwindigkeit chemischer Reaktionen. (05 BE) 4.2 Geben Sie die Reaktionsgleichung in Strukturformeln für die Entstehung von freien Fettsäu- ren (FFA) in Milch an (Material 1 und 2). Benennen Sie die Produkte und beschreiben Sie die ablaufende Reaktion. (08 BE) 4.3 Zeichnen Sie anhand der Messwerte aus Material 3 ein Konzentrations-Zeit-Diagramm für die FFA-Konzentrationen in Rohmilch und homogenisierter Rohmilch. Ermitteln Sie für die Entstehung von FFA in homogenisierter Rohmilch die Durchschnittsgeschwindigkeiten in den Lagerungszeiträumen von 0-1 und 1,2-2 Stunden. Erläutern Sie die Unterschiede der beiden Reaktionsgeschwindigkeiten. (10 BE) 4.4 Begründen Sie die Unterschiede der FFA-Konzentration in den ersten drei Stunden Lage- rungszeit bei Rohmilch und homogenisierter Rohmilch (Material 2 und 3). (07 BE) Anhang Diagrammvorlage für Aufgabe 4.3 Die Abbildung wurde aus urheberrechtlichen Gründen entfernt. CHE-GK-H Aufgabe 4 Seite 9 von 18

Die Senatorin Freie für Bildung und Wissenschaft Hansestadt Bremen Schriftliche Abiturprüfung 2015 im dritten Prüfungsfach Grundkurs Chemie Freitag, 24. April, 9.00 Uhr Unterlagen für Referenten und Korreferenten - Diese Unterlagen sind nicht für Schülerinnen und Schüler bestimmt - Diese Unterlagen enthalten … Allgemeines, Erwartungshorizonte, Bewertungen und Korrekturhinweise zu den Aufgaben, keine Aufgabenstellungen – Ihre Exemplare entnehmen Sie bitte den Schüleraufgaben – , einen Protokollbogen zur Auswahl der Aufgaben für die Prüfungsakten Ihrer Schule, einen Rückmeldebogen für die Zentralabiturkommission zur Auswahl der Aufgaben. Allgemeines Prüfen Sie die Prüfungsaufgaben vor der Aushändigung an die Schülerinnen und Schüler auf ihre Vollständigkeit und formale und inhaltliche Korrektheit und ergänzen Sie sie gegebenen- falls. Bei nicht ausreichender Anzahl erstellen Sie entsprechende Kopien vor Ort. Bei einem schwerwiegenden inhaltlichen Fehler informieren Sie sofort die Senatorin für Bildung und Wissenschaft von 7.00 bis 9.30. Die von der Senatorin für Bildung und Wissenschaft vorge- nommene Korrektur gibt die Schule sofort an die für die schriftliche Prüfung zuständige Lehr- kraft weiter. Wählen Sie gemeinsam mit Ihrer Korreferentin / Ihrem Korreferenten aus den vier vor- gelegten Aufgaben drei aus. Kommt es zu keiner Einigung, bestimmt die/der Vorsitzende des Fachprüfungsausschusses die Auswahl der Aufgaben (§ 10 Abs. 2 Nr. 1 AP-V). Proto- kollieren Sie auf dem beigefügten Protokollformular, welche Aufgaben Sie gewählt haben (Prüferin/Prüfer und Korreferentin/Korreferent und ggf. auch die/der Vorsitzende des Fach- prüfungsausschusses unterschreiben das Protokoll). Füllen Sie bitte für die Zentralabiturkommission Chemie den beigefügten Rückmeldebogen zur Auswahl der Aufgaben aus und schicken ihn an die dort genannte Adresse. Fragen Sie vor Verteilung der Aufgaben nach der Arbeitsfähigkeit der Schülerinnen und Schü- ler und weisen Sie diese auf die Regelungen des § 5 AP-V (Täuschung und Behinderung) hin. Machen Sie die Schülerinnen und Schüler auf die Arbeitshinweise aufmerksam, die am An- fang ihrer Unterlagen für die Prüfung stehen. Geben Sie ihnen ggf. die nötigen Angaben zur Schulnummer sowie zur genauen Kursbezeichnung. Die Bearbeitungszeit beträgt 180 Minuten. Erlaubte Hilfsmittel: Rechtschreiblexikon, Periodensystem der Elemente (als Bestandteil des Aufgabenvorschlages), Taschenrechner. CHE-GK-H-L Seite 10 von 18










