Che1-eA-A-SCAN-2017
Dieses Dokument ist Teil der Anfrage „Abitur-Aufgaben im Fach Chemie im Jahr 2017 in Hamburg“
Diese Anfrage wurde als Teil der Kampagne „Frag sie Abi!“ gestellt.
A
-s-
Freie und Hansestadt Hamburg
Behörde für Schule und Berufsbildung /
Kurs-Nr. / Name
Schriftliche Abiturprüfung
Schuljahr 2016/2017
Chemie
auf erhöhtem Anfordern ngsniveau
an allgemeinbildenden gymnasialen Oberstufen
Haupttermin
Mittwoch, 19. April 2017, 9:00 Uhr
Unterlagen für die Prüflinge
Allgemeine Arbeitshinweise
• Tragen Sie rechts oben auf diesem Blatt und auf Ihren Arbeitspapieren Ihren Namen sowie die
Kursnummer ein.
• Kennzeichnen Sie bitte Ihre Entwurfsblätter (Kladde) und Ihre Reinschrift.
Fachspezifische Arbeitshinweise1
• Die Arbeitszeit beträgt 300 Minuten.
• Eine Lese- und Auswahlzeit von 30 Minuten ist der Arbeitszeit vorgeschaltet. In dieser Zeit darf
nicht mit der Bearbeitung der Aufgaben begonnen werden.
• Erlaubte Hilfsmittel: Taschenrechner, Rechtschreibwörterbuch, Formelsammlung mit Periodens.
Aufgabenauswahl
• Sie erhalten drei Aufgaben zu unterschiedlichen Schwerpunktthemen
I: Stoff- und Energiewechsel der Grundnahrungsmittel Kohlenhydrate
II: Kohlenstoffdioxid und Klimawandel
III: Eigenschaften und Synthese von Kunststoffen
• Überprüfen Sie anhand der Seitenzahlen, ob Sie alle Unterlagen vollständig erhalten haben.
• Wählen Sie aus den Aufgaben zwei aus und bearbeiten Sie diese.
• Vermerken Sie hier auf dem Deckblatt und auf Ihrer Reinschrift, welche Aufgaben Sie ausgewählt
und bearbeitet haben.
Ausgewählt wurden:
Nummer und Schwerpunktthema der Aufgabe
Hinweise zu den Erleichterungen für neu zugewanderte Schülerinnen, Schüler und Prüflinge bei Sprachschwie-
rigkeiten in der deutschen Sprache finden sich auf S 2.
Chel-eA-A-2017 Deckblatt, Seite 1 von 4

Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abltur 2017 Chemie auf erhöhtem Anforderungsniveau Oberstufen
Deckblatt
Erleichterungen für neu Zugewanderte
Entsprechend der „Richtlinie über die Gewährung von Erleichterungen für neu zugewanderte Schüle-
rinnen, Schüler und Prüflinge bei Sprachschwierigkeiten in der deutschen Sprache" (MBlSchul Nr. 08,
7. Oktober 2016, S. 60) werden für die betroffenen Prüflinge die folgenden Erleichterungen gewährt:
• Die Bearbeitungszeit wird um 30 Minuten auf 330 Minuten erhöht.
• Ein nicht-elektronisches Wörterbuch Deutsch - Herkunftssprache / Herkunftssprache - Deutsch wird
bereitgestellt.
Chel-eA-A-2017 Deckblatt,Seite2von4

Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abitur 2017 Chemie auf erhöhtem Anforderungsniveau Oberstufen
Deckblatt
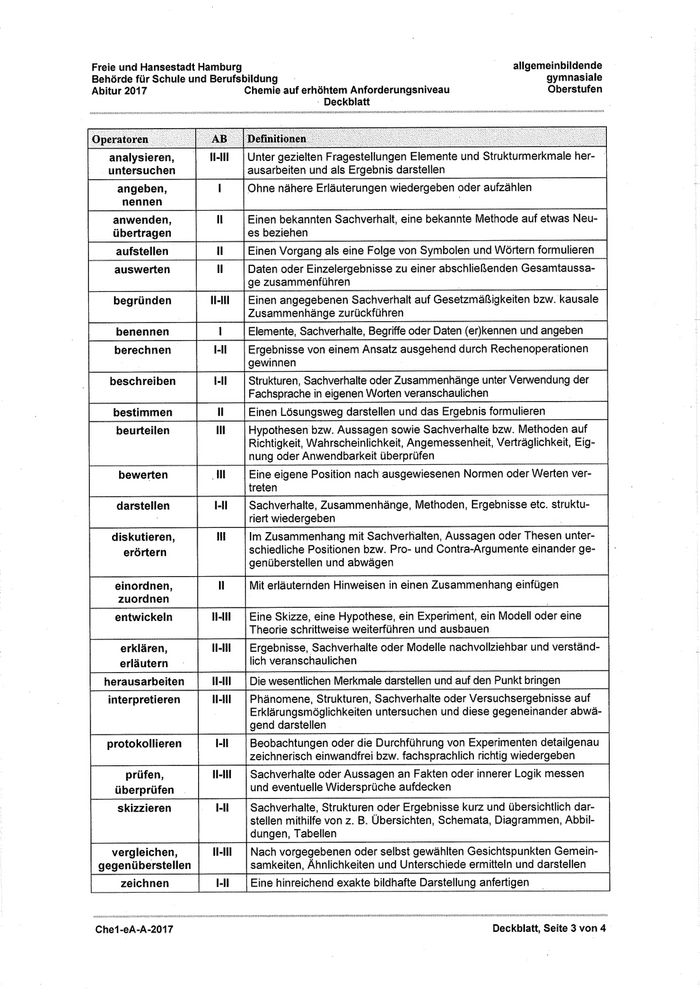
Qperatoren )AB', :fl)efHHt.onen,::I:i^^^^
analysieren, 11-111 Unter gezielten Fragestellungen Elemente und Strukturmerkmale her-
untersuchen ausarbeiten und als Ergebnis darstellen
angeben, l Ohne nähere Erläuterungen wiedergeben oder aufzählen
nennen
anwenden, Il Einen bekannten Sachverhalt, eine bekannte Methode auf etwas Neu-
übertragen es beziehen
aufstellen Il Einen Vorgang als eine Folge von Symbolen und Wörtern formulieren
auswerten Il Daten oder Einzelergebnisse zu einer abschließenden Gesamtaussa-
ge zusammenführen
begründen 11-111 Einen angegebenen Sachverhalt auf Gesetzmäßigkeiten bzw. kausale
Zusammenhänge zurückführen
benennen l Elemente, Sachverhalte, Begriffe oder Daten (er)kennen und angeben
berechnen 1-11 Ergebnisse von einem Ansatz ausgehend durch Rechenoperationen
gewinnen
beschreiben 1-11 Strukturen, Sachverhalte oder Zusammenhänge unter Verwendung der
Fachsprache in eigenen Worten veranschaulichen
bestimmen Il Einen Lösungsweg darstellen und das Ergebnis formulieren
beurteilen III Hypothesen bzw. Aussagen sowie Sachverhalte bzw. Methoden auf
Richtigkeit, Wahrscheinlichkeit, Angemessenheit, Verträglichkeit, Eig-
nung oder Anwendbarkeit überprüfen
bewerten III Eine eigene Position nach ausgewiesenen Normen oder Werten ver-
treten
darstellen 1-11 Sachverhalte, Zusammenhänge, Methoden, Ergebnisse etc. struktu-
riert wiedergeben
diskutieren, III Im Zusammenhang mit Sachvertialten, Aussagen oder Thesen unter-
erörtern schiedliche Positionen bzw. Pro- und Contra-Argumente einander ge-
genüberstellen und abwägen
einordnen, Il Mit erläuternden Hinweisen in einen Zusammenhang einfügen
zuordnen
entwickeln 11-111 Eine Skizze, eine Hypothese, ein Experiment, ein Modell oder eine
Theorie schrittweise weiterführen und ausbauen
erklären, 11-111 Ergebnisse, Sachverhalte oder Modelle nachvollziehbar und verständ-
erläutern lich veranschaulichen
herausarbeiten 11-111 Die wesentlichen Merkmale darstellen und auf den Punkt bringen
interpretieren 11-111 Phänomene, Strukturen, Sachverhalte oderVersuchsergebnisse auf
Erklärungsmöglichkeiten untersuchen und diese gegeneinander abwä-
gend darstellen
protokollieren 1-11 Beobachtungen oder die Durchführung von Experimenten detailgenau
zeichnerisch einwandfrei bzw. fachsprachlich richtig wiedergeben
prüfen, 11-111 Sachverhalte oder Aussagen an Fakten oder innerer Logik messen
überprüfen und eventuelle Widerspräche aufdecken
skizzieren 1-11 Sachverhalte, Strukturen oder Ergebnisse kurz und übersichtlich dar-
stellen mithilfe von z. B. Übersichten, Schemata, Diagrammen, Abbil-
düngen, Tabellen
vergleichen, 11-111 Nach vorgegebenen oder selbst gewählten Gesichtspunkten Gemein-
gegenüberstellen samkeiten, Ähnlichkeiten und Unterschiede ermitteln und darstellen
zeichnen 1-11 Eine hinreichend exakte bildhafte Darstellung anfertigen
Che1.eA-A.2017 Deckblatt, Seite 3 von 4
Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abitur 2017 Chemie auf erhöhtem Anforderungsniveau Oberstufen
Deckblatt
Erwartungshorizont und Bewertung
Bewertung:
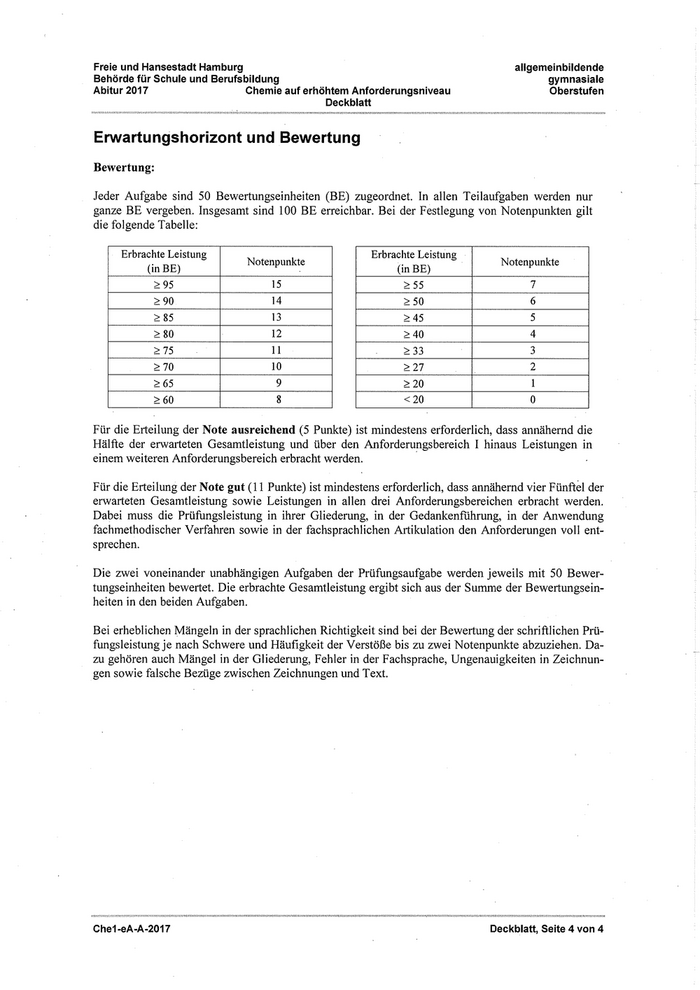
Jeder Aufgabe sind 50 Bewertungseinheiten (BE) zugeordnet. In allen Teilaufgaben werden nur
ganze BE vergeben. Insgesamt sind 100 BE erreichbar. Bei der Festlegung von Notenpunkten gilt
die folgende Tabelle:
Erbrachte Leistung Erbrachte Leistung
Notehpunkte Notenpunkte
(in BE) (in BE)
S 95 15 > 55 7
> 90 14 S 50 6
> 85 13 > 45 5
> 80 12 S: 40 4
^ 75 11 S 33 3
> 70 10 > 27 2
> 65 9 > 20 l
> 60 8 < 20 0
Für die Erteilung der Note ausreichend (5 Punkte) ist mindestens erforderlich, dass annähernd die
Hälfte der erwarteten Gesamtleistung und über den Anforderungsbereich I hinaus Leistungen in
einem weiteren Anforderungsbereich erbracht werden.
Für die Erteilung der Note gut (11 Punkte) ist mindestens erforderlich, dass annähernd vier Fünftel der
erwarteten Gesamtleistung sowie Leistungen in allen drei Anforderungsbereichen erbracht werden.
Dabei muss die Prüfungsleistung in ihrer Gliederung, in der Gedankenführung, in der Anwendung
fachmethodischer Verfahren sowie in der fachsprachlichen Artikulation den Anforderungen voll ent-
sprechen.
Die zwei voneinander unabhängigen Aufgaben der Prüfungsaufgabe werden jeweils mit 50 Bewer-
tungseinheiten bewertet. Die erbrachte Gesamtleistung ergibt sich aus der Summe der Bewertungsein-
heiten in den beiden Aufgaben.
Bei erheblichen Mängeln in der sprachlichen Richtigkeit sind bei der Bewertung der schriftlichen Prü-
fungsleistungje nach Schwere und Häufigkeit der Verstöße bis zu zwei Notenpunkte abzuziehen. Da-
zu gehören auch Mängel in der Gliederung, Fehler in der Fachsprache, Ungenauigkeiten in Zeichnun-
gen sowie falsche Bezüge zwischen Zeichnungen und Text.
Che1.eA-A.2017 Deckblatt, Seite 4 von 4
Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abitur2017 Oberstufen
Chemie auf erhöhtem Anforderungsniveau, Aufgabe l
Aufgabe l
Schwerpunktthema: Stoff- und Energiewechsel der
Grundnahrungsmittel Kohlenhydrate
Kestose ~ ein Speicherkohlenhydrat in Gräsern
Da die Sommergerste sehr kohlenhydratreich
ist, wird sie z. B. zum Bierbrauen verwendet.
In der Gerste findet sich u.a. das
Speicherkohlenhydrat Kestose. Um das
enzymhaltige Gerstenmalz zu erhalten,
werden die Körner zum Keimen gebracht,
dann getrocknet und die keimenden Wurzeln
entfernt. Danach werden sie zerkleinert und
mit warmem Wasser zur sogenannten Maische
vermischt. In der Maische werden
Stärkemoleküle zu vergärbarem Zucker
wwwxligiUiiefotienMe/biologieyßanzen/graesei'/tnsgerst.JPG, gespalten,
enliwmmen 24.02.16
Teilaufgaben:
a) Beschreiben Sie Nomenklatur und Aufbau des Glucosemoleküls mithilfe der Fischer-
Projektion und der Haworth-Darstellung unter besonderer Berücksichtigung seiner
Enantiomere, seines natürlichen Vorkommens, der D- und L-, sowie der a- und ß-Form.
(8 BE)
b) Stellen Sie die Bausteine und die Verknüpfungsart der Kestose (Material l) dar. (8 BE)
c) Die Kestose kann durch saure Hydrolyse in ihre Monosaccharide gespalten werden. Erläutern
Sie einen möglichen Mechanismus der sauren Hydrolyse unter Benennung der entstehenden
Monosaccharide. Stellen Sie den anschließenden Verlauf der Fehling-Probe mit
Reaktionsgleichungen und wesentlichen Beobachtungen dar. (12 BE)
d) Durch unvollständige Hydrolyse des Trisaccharids Kestose (Material l) können u. a. zwei
verschiedene Disaccharide (A und B) entstehen. Stellen Sie die Strukturformeln der beiden
Disaccharide dar und begründen Sie die zu beobachtenden Ergebnisse für die Veränderungen
bei der Polarimetrie (Material 2). (9 BE)
e) Arbeiten Sie unter Verwendung von Material l und 3 heraus, zu welchem Fruktan-Grundtyp
die Kestose gehört. Beurteilen Sie deren Wasserlöslichkeit sowie die Aussage, dass Fruktane
sich als Süßstofffür Diabetiker in Diätbieren und als Ballaststoff eignen (Material 4).
(13 BE)
Chel-eA-A-2017 Seite 1 von 3

Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abitur2017 Oberstufen
Chemie auf erhöhtem Anforderungsniveau, Aufgabe l
Anlagen zu Aufgabe l: Kestose - ein Speicherkohlenhydrat in Gräsern
Material 1: Information Kestose
Bei der Bierherstellung lassen sich in der
Maische niedermolekulare Kohlenhydrate
wie z. B. das Trisaccharid Kestose
nachweisen.
Unter Maische versteht man die Mischung
aus Wasser und geschrotetem HO
Getreidemalz, meist Gerstenmalz.
Malz nennt man gekeimte, getrocknete
Getreidekörner.
ÖH
10 Schrot besteht aus zerkleinerten oder
zerquetschten Getreidekörnern.
Strukturformel Kestose
Material 2: Polarimetrie der Lösung
Es werden nach unvollständiger Hydrolyse der Kestose von beiden dabei entstehenden Disacchariden
(A und B) jeweils wässrige Lösungen gleicher Konzentration hergestellt. Im Anschluss wird der
Drehwinkel mittels Polarimetrie bestimmt. Eine Woche später werden die Lösungen nochmals
polarimetrisch untersucht.
Eine der beiden Disaccharidlösungen ergibt im Polarimeter sowohl bei der ersten Bestimmung als
°'ml
auch eine Woche später einen spezifischen Drehwinkel von 66,5 -T—. Dieser Drehwinkel entspricht
dem der Saccharose. Die andere Lösung des Disaccharids zeigt einen sich verändernden Drehwinkel,
der nach einiger Zeit einen konstanten Wert annimmt.
Material 3: Information Fruktane
Fruktane zeichnen sich
Che1.eA-A.2017 Seite 2 von 3

Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abitur2017 Oberstufen
Chemie auf erhöhtem Anforderungsniveau, Aufgabe l
Fäulniserreger unterdrückt werden.
Ergänzt und verändert nach:
https://de.wikipedia.org/wiki/Frukfaiie, entnommen am 24.01.16 und http://www.dorispaas.de/oligosaccharide-wasistdas
entnommen am 24.01.16;
www.diabetes-heme.iim-duesseldorf.de/tools/prmt.html?TextID=2090,sntnommen am 24.01.16.
Habermehl et.al.:, Natnrstoffchemie. 3. Aufl. S. 405.
Material 4: Information Ballaststoff
Ballaststoffe sind weitgehend
|im Magen) verkürzt.
Ergänzt und verändert nach: https://de.wikipedia.org/wiki/Ballaststoff, entnommen am 29.01.16.
Che1.eA-A.2017 Seite 3 von 3

Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnaslale
Abltur2017 Oberstufen
Chemie auf erhöhtem Anforderungsniveau, Aufgabe II
Aufgabe II
Schwerpunktthema: Kohlenstoffdioxid und Klimawandel
Entstehung der nördlichen Kalkalpen
Vor etwas mehr als 200 Millionen Jahren, im Erdzeitalter
der Obertrias, entwickelten sich im Kontinentalschelf
des Kontinents Pangäa am Rand des Ozeans riesige
Carbonatplattformen.
Durch Auseinanderbrechen des Kontinents Pangäa im
Mitteljura und Verschiebung der afrikanischen Platte auf
die eurasische Platte wurden diese Sedimentgesteine
aufgeworfen und bilden, der Erosion durch Eis und Wind
ausgesetzt, die schroffen Berge der nördlichen Kalkalpen.
Karwendelgebirge bei Mittenwald (Bayern;
Teilaufgaben:
a) Stellen Sie die Bildung von Kalkstein in alkalischem calciumhaltigem Wasser durch aus der
Atmosphäre stammendes Kohlenstoffdioxid in den Einzelschritten Lösung, Deprotonierung und
Fällung dar.
(8 BE)
b) Erklären Sie mithilfe des Massenwirkungsgesetzes die Verschiebungen der Gleichgewichte bei der
Bildung von Kalkstein durch eine Erhöhung der Kohlenstoffdioxidkonzentration in der Atmosphäre.
Gehen Sie auch auf den Einfluss der H 3 0 - und OH'-Ionen ein.
(12 BE)
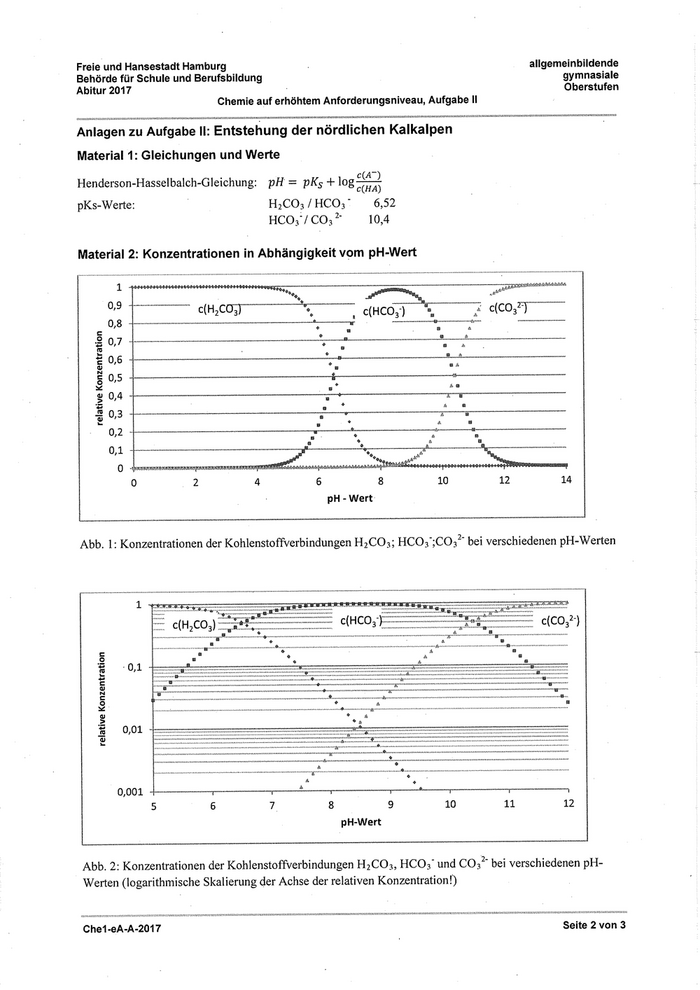
c) Beschreiben Sie die Abbildung in Material 2 und berechnen Sie mithilfe der Henderson-
Hasselbalch-Gleichung (Material l) die aus der Grafik in Material 2 entnehmbaren Werte der
Konzentrationen von HC03' und H2CÖ3 bei einem pH-Wert von 7,0.
(12 BE)
d) Erklären Sie, unter anderem mithilfe des Prinzips von Le Chatelier, warum sich carbonatbildende
Korallen (Material 3) bevorzugt im flachen Wasser bilden.
(9 BE)
e) Begründen Sie unter Verwendung von Material 4, warum anzunehmen ist, dass an der Bildung
großer Carbonatsedimente in der Trias andere Organismen als die heutigen Korallenarten
beteiligt gewesen sein müssen, und beurteilen Sie daraufhin die Befürchtungen der
K-limawissenschaftler (Material 5).
(9 BE)
Kontinentalschelf: Randbereich eines Kontinents, der vom Meer bedeckt ist, jedoch eine geringe
Meerestiefe aufweist.
Che1.eA-A.2017 Seite 1 von 3

Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abitur2017 Oberstufen
Chemie auf erhöhtem Anforderungsniveau, Aufgabe l
Anlagen zu Aufgabe II: Entstehung der nördlichen Kalkalpen
Material 1: Gleichungen und Werte
, c(A-)
Henderson-Hasselbalch-Gleichung: pH = pKg + log
'C(HA)
pKs-Werte: H2C03/HCÖ3' 6,52
HCO.i'/COs2" 10,4
Material 2: Konzentrationen in Abhängigkeit vom pH-Wert
l "^^^^^^M^^^^^MW^^^^M^MS^®^
pH-Wert
Abb. l: Konzentrationen der Kohlenstoffverbindungen H2CC>3; HC03';CÖ3 bei verschiedenen pH-Werten
"^^y^'^^'"'^^"^^^
^•^•^^••^^;^r:^::^:®x%^^;;T?^^ :^r:^^^^^m^x^^^:^;^^:::^^^€lt^^;rml"
c(^yCO^'z^*^zz^zzzzizzzzz ^^ ^ ^zzz^zzzzzz^zzz^^i'»^zzizzzii c(C03
.m..~. _..t,».,—......,..-...-.._„.„_.._„._................_*„..-..-_„.•..„........„..„.,_„.._...
0,1
•"%•""'•'•••••"
i~'B—
§
^
% 0,01
0,001
8 9 10 11 12
pH-Wert
Abb. 2: Konzentrationen der Kohlenstoffverbindungen H2CÖ3, HCO.-)' und COs2' bei verschiedenen pH-
Werten (logarithmische Skalierung der Achse der relativen Konzentration!)
Che1.eA-A.2017 Seite 2 von 3
Freie und Hansestadt Hamburg allgemeinbildende
Behörde für Schule und Berufsbildung gymnasiale
Abitur2017 Oberstufen
Chemie auf erhöhtem Anforderungsniveau, Aufgabe II
Material 3: Korallen
Korallen sind am Meeresboden festsitzende Meeresorganismen, die Skelette aus Kalkstein bilden. Oft
leben sie in einer Symbiose (Lebensgemeinschaft verschiedener Organismen, bei der jeder der
Organismen Vorteile von der Gemeinschaft hat) mit fotosynthesefähigen Algen. Diese Algen sind
einerseits für den Stoffwechsel der Koralle von Bedeutung, andererseits auch für die Fähigkeit der Koralle,
Kalk zu bilden. Die biogene Kalkbildung durch Korallen kann mit der Gleichgewichtsreaktion
Ca2+ + 2 HCOs" ^ CO-i + H^O + CaCOg beschrieben werden.
Material 4:
Atmosphärische und klimatische Bedingungen in derTrias (vor 250-200 Mio. Jahren))
Quelle: \) https://cie.wikipedia.org/wiki/Trias_(Geologie), entnommen am 28.10.15.
2) www.Spektriim.de/news/saurer-ozeaii-basorgt-schlimmstes-massenaiissterberi/l34l545, entnommen am 28.10.15.
Material 5: Kohlenstoffdioxid und Ozeane heute
Das Lösen des Gases Kohlenstoffdioxid in Meerwasser wird heute im Zusammenhang mit der
Klimaveränderung diskutiert. Dabei ist einerseits die Rolle der Ozeane als Kohlenstoffdioxidsenke (kann
CO; binden) von Bedeutung, andererseits stellt das zunehmende Lösen des Gases ein Problem für
kalkbildende Organismen wie Korallen dar.
Chel-eA-A-2017 Seite 3 von 3










