„Zugang zum Suchthilfesystem
Dieses Dokument ist Teil der Anfrage „Impfstoffe“
Prospektive Studie zur Sicherheit von Impfstoff(en) gegen Covid-19 und zum Schutz vor Erkrankung mittels Smartphone App (SaveVac-2) Paul-Ehrlich-Institut (PEI) Studiensekretariat des Paul-Ehrlich-Instituts (PEI), Referat Pharmakovigilanz S1, Paul-Ehrlich-Straße 51-59, 63225 Langen, Tel: 06103-77 1011, E-Mail: Studiensekretariat-S@pei.de Studienprotokoll Prospektive Studie zur Sicherheit von Impfstoff(en) gegen Covid-19 und zum Schutz vor Erkrankung mittels Smartphone App SafeVac 2.0 Version 1.1 13.12.2020 Seite 1 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-2- Beteiligte Institute und Mitarbeiter Projekttitel Prospektive Studie zur Sicherheit von Impfstoff(en) gegen Covid-19 und zum Schutz vor Erkrankung mittels Smartphone App Projektkürzel SafeVac 2.0 Datum 13.12.2020 Paul-Ehrlich-Institut Abteilung Sicherheit von Arzneimitteln und Medizinprodukten Referat Pharmakovigilanz S1 Paul-Ehrlich-Str. 51-59 Tel.: Fax: Email: Paul-Ehrlich-Institut Abteilung Sicherheit von Arzneimitteln und Medizinprodukten Referat Pharmakovigilanz S1 Paul-Ehrlich-Str. 51-59 Tel.: Fax: Email: Paul-Ehrlich-Institut Abteilung Sicherheit von Arzneimitteln und Medizinprodukten Referat Pharmakovigilanz S1 Paul-Ehrlich-Str. 51-59 Tel.: Fax: Email: Leiterin der Abteilung Sicherheit von Arzneimitteln und Medizinprodukten Paul-Ehrlich-Institut Abteilung Sicherheit von Arzneimitteln und Medizinprodukten Paul-Ehrlich-Str. 51-59 Tel.: Fax: Email: Paul-Ehrlich-Institut Seite 2 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-3- Abteilung Sicherheit von Arzneimitteln und Medizinprodukten Referat Pharmakovigilanz S2 Paul-Ehrlich-Straße 51-59 63225 Langen Tel: Fax: E-Mail: Paul-Ehrlich-Institut Abteilung Sicherheit von Arzneimitteln und Medizinprodukten Referat Pharmakovigilanz S1 Paul-Ehrlich-Straße 51-59 63225 Langen Tel: Fax: E-Mail: Kooperationspartner (App-Entwicklung) Materna Information & Communications SE Voßkuhle 37 44141 Dortmund Tel: Email: Seite 3 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-4- Inhalt Zusammenfassung ..................................................................................................................................... 5 1. Projektziele und Zielgrößen ................................................................................................................. 6 1.1. App zur Erfassung von UE nach COVID-19-Impfung und des Schutzes vor der Erkrankung .......... 6 1.2. Evaluierung der Software/Technologie (App) ............................................................................. 6 2. Hintergrund ........................................................................................................................................ 6 2.1. SARS-CoV-2 und COVID-19 ................................................................................................... 6 3. Material und Methoden ....................................................................................................................... 9 3.1. Studiendesign und Studienpopulation ....................................................................................... 9 3.2. Rekrutierung von Teilnehmern/innen ........................................................................................ 9 3.3. Beginn, zeitlicher Ablauf, Studiendauer, Erhebung, Studienabschluss ....................................... 10 3.4. Statistische Analyse .............................................................................................................. 12 3.5. Fallzahlschätzung ................................................................................................................. 12 3.6. Teilnehmerzahl..................................................................................................................... 12 3.7. Vorarbeiten .......................................................................................................................... 12 3.8. Technische Kenndaten der App ............................................................................................. 13 3.9. Datenerfassung mithilfe der SafeVac 2.0-App ......................................................................... 13 3.10. Technische Informationen zur Initialisierung der App und zum Meldevorgang ............................ 15 3.11. Technische Informationen zur Übermittlung der in die App eingegebenen Daten ........................ 15 3.12. Feedback-Fragen ................................................................................................................. 16 3.13. Technische Maßnahmen zum Schutz vor Missbrauch und unbefugtem Zugriff ........................... 16 3.14. Fristen für die Löschung der App-Daten nach Studienende ...................................................... 17 3.15. Widerruf der Teilnahme an der Studie .................................................................................... 18 3.16. Datenschutz ......................................................................................................................... 19 4. Ethische / rechtliche Gesichtspunkte .................................................................................................. 19 5. Anzeige der Studie ........................................................................................................................... 19 6. Verwendung der Ergebnisse.............................................................................................................. 19 7. Limitationen ..................................................................................................................................... 20 8. Anlagen ........................................................................................................................................... 20 9. Literaturverzeichnis........................................................................................................................... 21 10. Synopse ...................................................................................................................................... 22 Seite 4 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-5- Zusammenfassung Am 11.03.2020 hat die Weltgesundheitsorganisation (WHO) die SARS-CoV-2-Pandemie erklärt. Anfang Oktober2020 steht die Corona-Pandemie in Europa vor einer „zweiten Welle“, nachdem die Zahl der täglichen Neuinfektionen dank strikter Kontakt-, Ausgangs- und Reisebeschränkungen und adäquaten Hygienekonzepten bis Ende Mai 2020 in Deutschland und anderen europäischen Staaten stark rückläufig war. Seit Februar 2020 werden weltweit und auch in Deutschland Impfstoffentwicklungen zum Schutz vor COVID-19 und zur Unterbrechung der Pandemie vorangetrieben. Dabei werden auch neuartige Impfstoffkonzepte z.B. RNA/DNA-Impfstoffe, Vektorimpfstoffe und adjuvantierte (rekombinante) Sub-Unit-Impfstoffe in klinischen Prüfungen getestet. Vor diesem Hintergrund ist es möglich, dass 2021 erfolgreich in klinischen Prüfungen getestete Impfstoffe zum Schutz vor COVID-19 zur Verfügung stehen und verimpft werden. Das Paul-Ehrlich-Institut (PEI) möchte bei der Anwendung von einem oder mehreren potenziellen Impfstoffen zum Schutz vor COVID-19 eine prospektive einarmige nicht-interventionelle Kohortenstudie an Erwachsenen (≥ 18 Jahre) durchführen, die mit einem COVID-19-Impfstoff geimpft werden. Die Studie ist Teil einer proaktiven Surveillance der Impfstoffsicherheit. Sie dient dazu, möglichst zeitnah quantitative Erkenntnisse zum Sicherheitsprofil der Covid-19-Impfstoffe zu erhalten, wobei in Abhängigkeit von der Teilnehmerzahl auch (sehr) seltene und/oder verzögert auftretende unerwünschte Ereignisse detektiert werden können. Zudem soll untersucht werden, wie viele der Teilnehmer/innen keine unerwünschten Ereignisse berichteten, d.h. die Impfung gut vertragen haben. Des Weiteren gibt sie Auskunft über den Schutz vor COVID-19 bei Geimpften innerhalb von 12 Monaten. Die Teilnehmer/innen der Studie sollen die Verträglichkeit der Impfstoffe mittels Smartphone App zu 7 (erste Dosis) bzw. 8 (zweite Dosis) Zeitpunkten innerhalb von 3 bzw. 4 Wochen nach jeder Impfung (erste/zweite Dosis) dokumentieren und dem PEI elektronisch mit einer Zufallsnummer mitteilen. Zusätzlich werden die Teilnehmer/innen nach 6 und 12 Monaten nach ihrem Gesundheitszustand befragt. Außerdem werden sie gebeten, mitzuteilen, ob zwischenzeitlich eine COVID-19-Erkrankung aufgetreten ist und, wenn ja, wie schwer die Erkrankung war. Basierend auf den Ergebnissen dieser Studie können die ermittelten Inzidenzen für unerwünschte Ereignisse im Rahmen einer Observed-versus-Expected (OvE)-Analyse mit alters- und geschlechtsspezifischen Hintergrundinzidenzen dieser Ereignisse in der Bevölkerung verglichen werden, wobei Sicherheitssignale detektiert werden können. Die neu entwickelte Smartphone App trägt zu einer proaktiven Post-Marketing Surveillance bei, über die mögliche Impfstoffrisiken rasch erkannt, untersucht und minimiert werden können. Seite 5 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-6- 1. Projektziele und Zielgrößen Das Projekt dient der Evaluation der App-gestützten Erfassung von unerwünschten Ereignissen (UE) und des Schutzes vor der Krankheit nach der Impfung gegen COVID (Corona virus disease)-19 mit zugelassenen Impfstoffen im Rahmen der Post-Marketing Surveillance in Deutschland. Daraus resultieren folgende Hypothesen und Zielgrößen: 1.1. App zur Erfassung von UE nach COVID-19-Impfung und des Schutzes vor der Erkrankung - Erfassung der Art, Schwere, Häufigkeit und des Verlaufs von UE nach COVID-19-Impfung bezogen auf die Anzahl geimpfter Personen (Nenner); - Erfassung von Zeitintervallen zwischen Impfung und Auftreten von UE („time to onset“) und Dauer von UE mit einem Follow-up-Zeitraum bis zu 4 Wochen nach jeder Impfung; - Rechallenge, d.h. Wiederauftreten bestimmter UE nach Verabreichen einer weiteren Dosis; - Detektion (sehr) seltener und/oder verzögert auftretender UE in Abhängigkeit von der Zahl der Teilnehmer/innen; - Erfassung der Häufigkeit von Impflingen, die nach Covid-19 Impfung keine UE berichteten, d.h. die Impfung gut vertragen haben; - Erfassung des Schutzes vor Infektion mit SARS-CoV-2 bis zu 12 Monaten nach der letzten Impfung. 1.2. Evaluierung der Software/Technologie (App) - Die Altersstruktur der Teilnehmer/innen gibt Auskunft über die Akzeptanz der Technologie in verschiedenen Altersgruppen; - Evaluation der Benutzerfreundlichkeit der App durch die Teilnehmer/innen; - Evaluation der Hinweise zur Verbesserung der Benutzerfreundlichkeit der App durch die Teilnehmer/innen. 2. Hintergrund 2.1. SARS-CoV-2 und COVID-19 Im Dezember 2019 wurde aus China von Patienten mit Pneumonie unbekanntem Ursprungs berichtet. Das Besondere daran war, dass die Fälle im Vorfeld ihrer Erkrankung Kontakt zu einem Wildtiermarkt in Wuhan, Provinz Hubei, hatten (Zhu et al. 2020; Del Rio und Malani 2020). Nur wenig später wurde ein neuartiges Coronavirus (zunächst provisorisch als 2019-nCoV, später als SARS-CoV-2 bezeichnet) als der Erreger der neuen Lungenerkrankung, COVID-19, identifiziert (Zhu et al. 2020). Seite 6 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-7- Am 30. Januar 2020 erklärte die Weltgesundheitsorganisation (WHO) aufgrund steigender Fallzahlen, nicht nur in China, sondern auch in anderen Ländern den COVID-19-Ausbruch zu einer Gesundheitlichen Notlage mit internationaler Tragweite (Public Health Emergency of International Concern, PHEIC)1 und am 12.03.2020 zur Pandemie2. Bis 30.09.2020 wurden gemäß COVID-19-Dashboard der Johns-Hopkins University3 weltweit 33.676.272 Infektionen mit SARS-CoV-2 berichtet, davon 1.008.411 mit tödlichem Ausgang. Seit Beginn der Pandemie sind gemäß COVID-19-Dashboard des Robert-Koch-Instituts (RKI)4, das auf den aus den Gesundheitsämtern gemäß IfSG übermittelten Meldedaten basiert, insgesamt 289.219 Infektionen mit SARS-CoV-2 in Deutschland bestätigt worden, etwa 256.000 davon sind bereits genesen und 9.488 Patienten sind an der Erkrankung gestorben. Nach einem Rückgang der täglichen Anzahl von Neuinfektionen bis Ende Mai dank strikter Kontakt-, Ausgangs-, und Reisebeschränkungen und eines adäquaten Hygienekonzepts steigen die Fallzahlen nach Lockerung der Maßnahmen zur Eindämmung der Pandemie zurzeit wieder an. Am 30.09.2020 wurden insgesamt 1.798 Neuinfektionen berichtet, während die Zahl Ende Mai noch bei 74 lag. Das klinische Bild umfasst u.a. Fieber, Schüttelfrost, Husten, Auswurf, Dyspnoe, Pneumonie, Niesen, Rhinorrhö, Halsschmerzen, Geschmacks- und Geruchsverlust, Kopfschmerzen, Myalgie sowie gastrointestinale Symptome wie Diarrhö. Schwer betroffene Patienten entwickeln eine ausgeprägte Hypoxämie und benötigen Sauerstoff oder müssen gar invasiv beatmet werden. Es werden zwar einige Medikamente, z.B. Remdesivir (Beigel et al. 2020) oder Dexamethason (Horby et al. 2020), in der Therapie von schwerkranken COVID-19-Patienten eingesetzt, es gibt aber noch keine kurative Therapie.. Zahlreiche Impfstoff-Entwicklungen laufen weltweit mit hoher Intensität, für einige Impfstoffkandidaten laufen auch bereits klinische Studien an mehreren zehntausende Probanden. Sofern diese Studiendaten positiv sind, könnten Zulassungen von Corona Impfstoffen noch in diesem Jahr erfolgen. Bei der europäischen Arzneimittelzulassung EMA werden erste Anträge zur Prüfung bereits in den kommenden Monaten erwartet. Ein genaues Datum/ein genauer Zeitraum lässt sich aber noch nicht absehen. 1 https://www.who.int/news-room/detail/30-01-2020-statement-on-the-second-meeting-of-the-international-health-regulations- (2005)-emergency-committee-regarding-the-outbreak-of-novel-coronavirus-(2019-ncov) 2 https://www.euro.who.int/de/health-topics/health-emergencies/coronavirus-covid-19/news/news/2020/3/who-announces- covid-19-outbreak-a-pandemic 3 https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6 4 https://experience.arcgis.com/experience/478220a4c454480e823b17327b2bf1d4 Seite 7 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-8- Möglich scheint es aber zu sein, dass es diesmal gelingt, so schnell wie noch nie einen Impfstoff zu entwickeln, der den hohen nationalen und internationalen Qualitätsanforderungen entspricht. Die Zulassung eines Impfstoffs heißt noch nicht, dass dieser sofort für die gesamte Bevölkerung zur Verfügung stehen wird. Es ist Aufgabe der Ständigen Impfkommission (STIKO) zu priorisieren. Deutschland fördert aktiv sowohl national als auch in enger Zusammenarbeit mit der Europäischen Kommission und den EU- Mitgliedsländern den rechtzeitigen Aufbau von Impfstoff-Produktionskapazitäten in Deutschland und der EU. Dabei werden mit den Impfstoffentwicklern auch Verträge zur ausreichenden Versorgung der Bevölkerung in Deutschland und Europa mit potenziellen COVID-19-Impfstoffen geschlossen. Neben bewährten Impfstoffkonzepten (inaktivierte Impfstoffe mit/ohne Adjuvans) werden auch neuartige Entwicklungen (Vektor-, DNA-, mRNA-Impfstoffe) vorangetrieben. Erste vielversprechende Resultate zur Sicherheit und Immunogenität in Phase-I/II-Studien wurden bereits publiziert (Mulligan et al. 2020; Folegatti et al. 2020). Einige Impfstoffe haben bereits mit der Phase III begonnen. Dabei ist zu bedenken, dass auch randomisierte klinische Prüfungen als Goldstandard im Hinblick auf die Bewertung der Sicherheit von neuen Impfstoffen Limitierungen unterliegen, auf die schon Rogers im Jahr 1991 hingewiesen hat (Rogers 1991): too few subjects: zu wenige Teilnehmer an klinischen Prüfungen, um weniger häufig vorkommende Nebenwirkungen zuverlässig zu erkennen; too simple in terms of comorbidities or concomitantly administered drugs: Prüfungsteilnehmer mit geringer Komorbidität werden zumeist bevorzugt in klinische Prüfungen eingeschlossen, um homogene Studienergebnisse zu erzielen; too median-aged subject pool: Zumeist werden wenige sehr junge und sehr alte Teilnehmer in klinische Prüfungen einbezogen; too narrow a definition of the clinical condition: sehr strikte Ein- und Ausschlusskriterien, um Heterogenität zu verringern; too brief period for evaluation: Zumeist ist die Beobachtungsdauer zu kurz, um Nebenwirkungen, die mit einer Verzögerung auftreten sicher zu erfassen. Diese Limitierungen führen dazu, dass das Nebenwirkungsprofil neuartiger Impfstoffe auf der Basis klinischer Prüfungen vor der Vermarktung nicht vollständig bekannt ist. Um eine Impfkampagne erfolgreich durchführen zu können, sollten im Rahmen einer proaktiven Post-Marketing Surveillance mögliche Impfstoffrisiken rasch erkannt, untersucht und minimiert werden. Ein wesentliches Element der Post-Marketing Surveillance ist die sogenannte Spontanerfassung von Verdachtsfällen von Nebenwirkungen und Impfkomplikationen gemäß §§ 6,8 +11 des Infektionsschutzgesetzes Seite 8 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

-9- (IfSG) und § 63 c des Arzneimittelgesetzes (AMG). Neben der unbekannten Dunkelzifferrate (es werden nicht alle UE gemeldet), ist ein wesentlicher Nachteil, dass dem PEI nur Berichte zu UE gemeldet werden, nicht jedoch zur guten Verträglichkeit bei Impflingen (keine UE). Daher sind Spontanmeldungen von Verdachtsfällen von Nebenwirkungen/Impfkomplikationen geeignet, mögliche Risikosignale zu detektieren, allerdings können diese nicht quantifiziert werden, da die Anzahl der verimpften Dosen sowie die absolute Häufigkeit der nicht berichteten UEs unbekannt sind. Auch können keine Aussagen zur Kausalität gemacht werden, da auch zeitlich zufällig mit einer Impfung zusammenfallende UE gemeldet werden. Um die Häufigkeit von UE zu bestimmen und die Assoziation zur Impfung ermitteln zu können, sind zumeist weitere pharmokoepidemiologische Studien unerlässlich. 3. Material und Methoden 3.1. Studiendesign und Studienpopulation Durchgeführt werden soll eine prospektive einarmige nicht-interventionelle Kohortenstudie mit einem Follow- up-Zeitraum von jeweils 3 bzw. 4 Wochen nach jeder Impfung bzgl. der Sicherheit von COVID-19-Impfstoffen bzw. bis 12 Monate nach der letzten Impfung bzgl. des Schutzes vor der Erkrankung. Die Studienpopulation umfasst erwachsene COVID-19-Impflinge. 3.2. Rekrutierung von Teilnehmern/innen Es ist geplant, Informationsmaterial, das auf die Studie aufmerksam machen soll, in impfenden Einrichtungen auszulegen. Zu diesem Zweck wird das PEI eine Informationsbroschüre entwerfen, mit deren Hilfe Hintergrund, Methode und Ziele der Studie erklärt werden sollen. Neben einem Flyer zur Studie wird vorab auch der App-Download SafeVac 2.0 zur Verfügung gestellt. Bei Rückfragen zum Studienablauf oder zur Technik bzw. bei technischen Problemen können sich impfende Ärzte/innen oder Nutzer/innen jederzeit telefonisch oder per E-Mail an das PEI werden. Dieses Informationsmaterial wird auch online auf der PEI Homepage zur Verfügung gestellt. Ferner soll im Deutschen Ärzteblatt auf die Studie aufmerksam gemacht werden. Einschlusskriterien: - ≥18 Jahre; - Deutsch- bzw. Englischsprachigkeit; - mindestens eine stattgehabte Impfung gegen COVID-19; - Besitz eines eigenen App-kompatiblen Smartphone (iOS ≥12, Android ≥5.0); - Einwilligung zur Studienteilnahme (elektronisch in der App); - Impfung mit einer Dosis eines COVID-19-Impfstoffes innerhalb der letzten 48 Stunden vor Initialisierung der App. Seite 9 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020

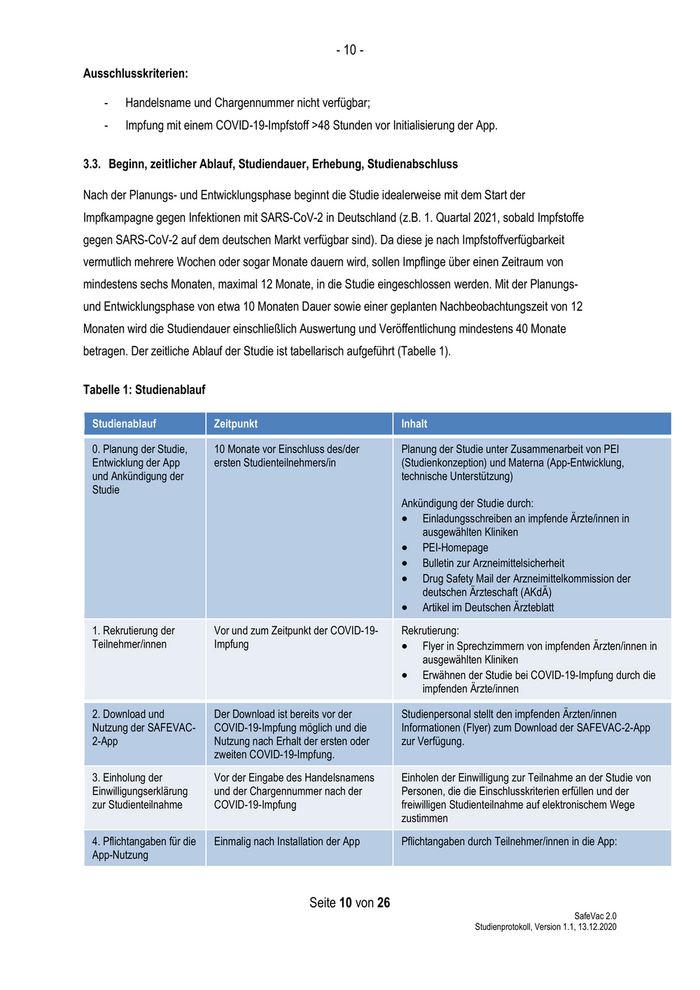
- 10 - Ausschlusskriterien: - Handelsname und Chargennummer nicht verfügbar; - Impfung mit einem COVID-19-Impfstoff >48 Stunden vor Initialisierung der App. 3.3. Beginn, zeitlicher Ablauf, Studiendauer, Erhebung, Studienabschluss Nach der Planungs- und Entwicklungsphase beginnt die Studie idealerweise mit dem Start der Impfkampagne gegen Infektionen mit SARS-CoV-2 in Deutschland (z.B. 1. Quartal 2021, sobald Impfstoffe gegen SARS-CoV-2 auf dem deutschen Markt verfügbar sind). Da diese je nach Impfstoffverfügbarkeit vermutlich mehrere Wochen oder sogar Monate dauern wird, sollen Impflinge über einen Zeitraum von mindestens sechs Monaten, maximal 12 Monate, in die Studie eingeschlossen werden. Mit der Planungs- und Entwicklungsphase von etwa 10 Monaten Dauer sowie einer geplanten Nachbeobachtungszeit von 12 Monaten wird die Studiendauer einschließlich Auswertung und Veröffentlichung mindestens 40 Monate betragen. Der zeitliche Ablauf der Studie ist tabellarisch aufgeführt (Tabelle 1). Tabelle 1: Studienablauf Studienablauf Zeitpunkt Inhalt 0. Planung der Studie, 10 Monate vor Einschluss des/der Planung der Studie unter Zusammenarbeit von PEI Entwicklung der App ersten Studienteilnehmers/in (Studienkonzeption) und Materna (App-Entwicklung, und Ankündigung der technische Unterstützung) Studie Ankündigung der Studie durch: Einladungsschreiben an impfende Ärzte/innen in ausgewählten Kliniken PEI-Homepage Bulletin zur Arzneimittelsicherheit Drug Safety Mail der Arzneimittelkommission der deutschen Ärzteschaft (AKdÄ) Artikel im Deutschen Ärzteblatt 1. Rekrutierung der Vor und zum Zeitpunkt der COVID-19- Rekrutierung: Teilnehmer/innen Impfung Flyer in Sprechzimmern von impfenden Ärzten/innen in ausgewählten Kliniken Erwähnen der Studie bei COVID-19-Impfung durch die impfenden Ärzte/innen 2. Download und Der Download ist bereits vor der Studienpersonal stellt den impfenden Ärzten/innen Nutzung der SAFEVAC- COVID-19-Impfung möglich und die Informationen (Flyer) zum Download der SAFEVAC-2-App 2-App Nutzung nach Erhalt der ersten oder zur Verfügung. zweiten COVID-19-Impfung. 3. Einholung der Vor der Eingabe des Handelsnamens Einholen der Einwilligung zur Teilnahme an der Studie von Einwilligungserklärung und der Chargennummer nach der Personen, die die Einschlusskriterien erfüllen und der zur Studienteilnahme COVID-19-Impfung freiwilligen Studienteilnahme auf elektronischem Wege zustimmen 4. Pflichtangaben für die Einmalig nach Installation der App Pflichtangaben durch Teilnehmer/innen in die App: App-Nutzung Seite 10 von 26 SafeVac 2.0 Studienprotokoll, Version 1.1, 13.12.2020